Fecha de recepción: julio 2 de 2021 Fecha de aceptación: mayo 20 2022
ARTíCULO DE REVISIóN https://dx.doi.org/10.14482/sun.39.01.611.729
Relación entre el ojo seco y la diabetes mellitus tipo 2
Relationship between dry eye and Type 2 Diabetes Mellitus
Timothy J. González Laura G. Páez2, Miguel A. Culman3, Sandra Carolina Durán C.4
1 Estudiante de Optometría, Universidad de La Salle, Bogotá, Colombia. Orcid: https//orcid.org/0000-0002-5356-2029. CvLAC: https://scienti.minciencias.gov.co/cvlac/visualizador/generarCurriculoCv.do?cod_rh=0001941672. tgonzalez34@unisalle.edu.co
2 Estudiante de Optometría, Universidad de La Salle, Bogotá, Colombia. Orcid: https://orcid.org/0000-0003-0163-4219. CvLAC: https://scienti.minciencias.gov.co/cvlac/visualizador/generarCurriculoCv.do?cod_rh=0001978338. lapaez12@unisalle.edu.co
3 Estudiante de Optometría, Universidad de La Salle, Bogotá, Colombia. Orcid: https://orcid.org/0000-0002-9956-8071. CvLAC: https://scienti.minciencias.gov.co/cvlac/visualizador/generarCurriculoCv.do?cod_rh=0002020519. mculman55@unisalle.edu.co
4 Optómetra, Magister en Ciencias Básicas Biomédicas, Estudiante Doctorado óptica, Optometría y Visión, Universidad Complutense de Madrid, España. Docente Investigador Facultad Ciencias de la Salud, Universidad de la Salle, Bogotá, Colombia. Orcid: orcid.org/0000-0002-5366-8552. CvLAC:https://scienti.minciencias.gov.co/cvlac/visualizador/generarCurriculoCv.do?cod_rh=0001417927. sduran@unisalle.edu.co
Correspondencia: Sandra Carolina Durán Cristiano: sduran@unisalle.edu.co. Facultad Ciencias de la Salud, Universidad de La Salle. Carrera 5 n.° 59 A 44, Bogotá, Colombia.
RESUMEN
La diabetes mellitus es una patología metabólica que altera los niveles de glucosa en el cuerpo, siendo más prevalente la tipo 2, la cual puede llegar a modular enfermedades sistémicas que causan diferentes desórdenes metabólicos y cambios celulares. En cuanto a las alteraciones oftalmológicas, se pueden resaltar la retinopatía diabética y el ojo seco, siendo esta última una condición inflamatoria crónica que ocaciona daños en la superficie ocular. Por lo tanto, esta revisión brindará información de los factores asociados al desarrollo de ojo seco en la diabetes, resaltando cambios en la glicemia y el rol del metabolismo de glucosa sobre estructuras oculares tales como como la glándula lagrimal, glándulas de Meibomio, y en la microvasculatura, que pueden condicionar a trastornos neuropáticos que conducen a la sintomatología ocular. De igual modo, se describen eventos biológicos como cambios en la expresión epigenética, estrés oxidativo e inflamación que presumiblemente juegan un papel importante en las diabetes y ojo seco, por lo cual la evaluación y análisis de la lágrima en esta población se hace necesaria, teniendo en cuenta los cambios en las estructuras oculares en la diabetes y las novedosas investigaciones sobre biomarcadores de diabetes a través de la película lagrimal.
Palabras clave: diabetes mellitus, ojo seco, glucemia, lágrima, inflamación.
ABSTRACT
Diabetes mellitus is a metabolic pathology that alters glucose levels in the body, being type 2 more prevalent, which can lead to modular systemic diseases that cause different metabolic disorders and cellular changes. Regarding ophthalmological alterations, diabetic retinopathy and dry eye can be highlighted, the latter being a chronic inflammatory condition causing damage to the ocular surface. Therefore, this review will provide information on the factors associated with the development of the dry eye in diabetes, highlighting changes in glycemia and the role of glucose metabolism on ocular structures such as the lacrimal gland, Meibomian glands, and the microvasculature, which can condition neuropathic disorders that lead to ocular symptoms, biological events such as changes in epigenetic expression, oxidative stress, and inflammation are prescribed, which presumably play an important role in diabetes and dry eye, for which the evaluation and analysis of tears in this population is done necessary, taking into account the changes in the ocular structures in diabetes and the new research on biomarkers of diabetes through the tear film.
Keywords: diabetes mellitus, dry eye, glucose, tear film, inflammation.
INTRODUCCIóN
Se habla de la diabetes mellitus (DM) como un problema de salud mundial, la cual es causada por una alteración metabólica que se caracteriza por hiperglucemia crónica (concentración excesiva de glucosa en la sangre), debida en algunos casos a un defecto en la secreción de insulina (1). Además, se asocia con daño, disfunción y falla de varios órganos y sistemas, especialmente riñones, nervios, corazón, vasos sanguíneos y en gran importancia el sistema visual (1). Para el 2014 se tenía que en Latinoamérica el 9.3 % de hombres y el 8.1 % de mujeres presentaban DM, siendo los países con mayor prevalencia Guyana, Surinam, Chile y Argentina (2). En Colombia, para 2015 fueron reportados 920 494 casos de diabetes mellitus, para una prevalencia de 1.9 casos por 100 000 habitantes y de 2.1 casos por 100 000 afiliados (3). En contraste, para 2020 se encontró que 3 de cada 100 colombianos presenta DM, sin embargo, el número puede ser mayor, debido a que muchos individuos no saben que padecen esta patología, y a partir de esta se pueden desencadenar alteraciones oculares, como lo es el ojo seco. La enfermedad de ojo seco (EOS) se define como una condición inflamatoria causadas por diferentes etiologías y que alteran la unidad funcional lagrimal (UFL), y por esta razón afecta negativamente la visión, ya sea por daños estructurales o funcionales (2). En las últimas décadas se ha abordado la relevancia de la lágrima a través de análisis experimentales, que han demostrado que existe un complejo molecular donde lípidos, proteínas, genes, etc., pueden inferir en la condición ocular y sistémica.
Por lo anterior, este articulo pretende brindar información sobre la relación que existe entre el ojo seco y la DM, en especial la tipo 2. Esto con el fin de ser utilizada por el profesional de la salud en búsqueda de etiologías causantes de ojo seco y generar un panorama de los posibles eventos biológicos relacionados entre diabetes y ojo seco. Asimismo, entendiendo la relación entre ojo seco y DM, el profesional de la salud podría implementar análisis glicémicos a partir del fluido lagrimal, realizar seguimiento de la DM a partir de la evaluación de funciones oculares, en las que la glicemia juega un papel importante.
Diabetes mellitus
La diabetes mellitus (DM) es una enfermedad sistémica debido a una alteración metabólica que tiene como resultado un exceso de glucosa en la sangre. Se puede catalogar la diabetes en dos tipos principalmente: tipo 1 (existencia de un defecto en la producción de insulina) y tipo 2 (incapacidad para utilizar correctamente la insulina) (4).
A su vez, hay múltiples rutas metabólicas alteradas relacionadas con el estado de la hiperglucemia, las cuales son determinantes en el inicio y progresión de la enfermedad. Por esto, se puede llegar a encontrar a nivel sistémico complicaciones microvasculares, que generan morbilidad y mortalidad asociada a la enfermedad, entre ellas la denominada neuropatía diabética (5).
En la diabetes de tipo 2 se pueden encontrar múltiples manifestaciones, no obstante, estas varían en cada persona, e incluso las personas no llegan a presentar ninguna de estas manifestaciones. Entre los síntomas más comunes están: infecciones frecuentes que no se resuelven fácilmente, niveles elevados de azúcar en la sangre y orina, poliuria, polidipsia, polifagia, irritabilidad, cambios del estado de ánimo, piel seca, cansancio, pérdida de sensibilidad en extremidades y visión borrosa (6).
A medida que evoluciona la enfermedad suelen aparecer neuropatías autonómicas, como pueden ser gastropatía, enteropatía, disfunción eréctil, hipotensión ortostática y denervación cardíaca. Se habla de la cardiopatía isquémica y la insuficiencia cardíaca como las patologías derivadas de control y seguimiento más complejo, además, estas llegan a facilitar la aparición de hipertensión arterial (7).
Desde el punto de vista fisiopatológico de la DM, se pueden encontrar diversos eventos biológicos que van desde la genética, epigenética y eventos moleculares y celulares que contribuyen a su aparición. Desde la genética, existe evidencia, que sugiere mutaciones en genes relacionados con el metabolismo de la glucosa, así como cambios en la actividad de factores de transcripción, como lo es "forkhead box protein O" (FOXO), factor de transcripción que contribuye a la regulación hormonal, señalización neuronal, producción lipídica y a la respuesta inflamatoria y vascular (8-10).
Por otro lado, existe una fuerte evidencia, de que factores como la obesidad, consumo de cigarrillo y poca actividad física pueden regular eventos epigenéticos que favorecen el desarrollo de la DM (11-13), es así que Jia et al. describieron modificaciones en la histona H3, la actividad de ciertos miRNAs, y cambios en la expresión del factor de crecimiento transformante β1 (TGF-β) asociado a nefropatía diabética (14,15). De modo que estos cambios podrían conducir a una desregulación de eventos, como la inflamación, estrés oxidativo, disfunción mitocondrial y finalmente apopto-sis que conlleva a la falla de las células pancreáticas (16,17).
El sistema visual requiere de una actividad biológica intrínseca adecuada para llevar a cabo su función. Por consiguiente, algunos estudios respaldan que cambios en la actividad hormonal, metabólica e inflamatoria conducen a posibles afectaciones de manera negativa para la salud visual (18-20), tal es el caso de la presentación de trastornos de la superficie ocular en individuos con DM (21,22).
El globo ocular puede llegar a sufrir daños por la DM, como es el caso de los microvasos de la retina, en el que principalmente las células endoteliales pueden verse afectadas por la hiperglicemia; entre dichos cambios se describen la disfunción endotelial, y por ende, la expresión de moléculas, como la molécula de adhesión vascular (VCAM) y la molécula de adhesión intercelular (ICAM), que favorecen procesos de angiogénesis y la activación de la cascada de coagulación (23), que resultan finalmente en la formación de áreas pequeñas de isquemia retiniana y que llegan a convertirse en retinopatía diabética (RD), siendo la tercera causa de ceguera en el mundo. A su vez, se habla de otras patologías derivadas, como es la catarata diabética, glaucoma neovascular, infecciones recurrentes en los párpados, cambios en la agudeza visual y enfermedad de ojo seco.
Enfermedad de ojo seco
La película lagrimal es una estructura húmeda que cubre toda la superficie ocular y puede disminuir con los años; está compuesta por 2 capas: lipídica (producida por las glándulas de Meibomio y lípidos de la película lagrimal) y muco-acuosa (conformada por la mucina, agua y electrolitos que aporta las células caliciformes y la glándula lagrimal respectivamente) (Figura 1), las cuales contribuyen a la reducción de la evaporación, función antimicrobiana, hidratación y adherencia; además son sustancias fundamentales ante determinadas trastornos oculares que se pueden asociar a la pérdida de homeostasis de dichas moléculas. Por otra parte, la película lagrimal puede alterarse por la constante exposición de la superficie ocular al ambiente, lo que da lugar a déficits de la lágrima (24).
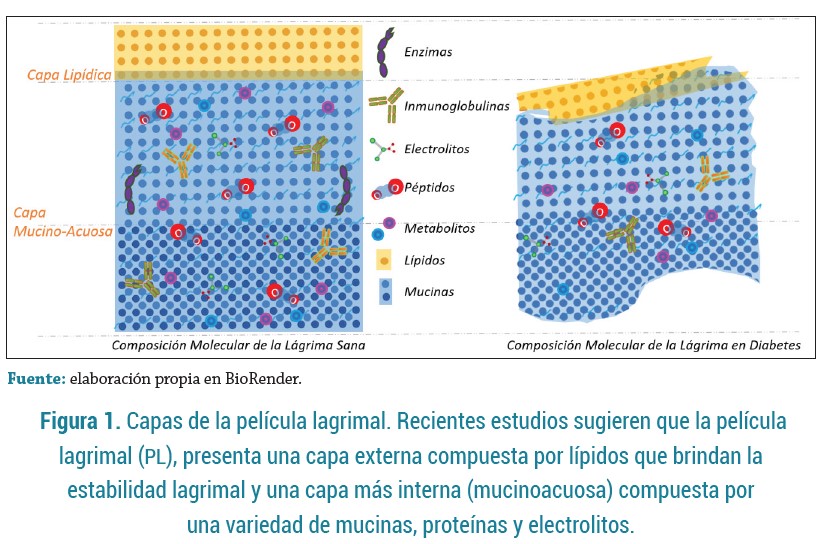
La lágrima hace parte de los fluidos biológicos corporales y está compuesta por una amplia gama de moléculas tales como las proteínas, péptidos, electrolitos, enzimas, inmunoglobulinas, lípidos y metabolitos, que necesitan un equilibrio para garantizar una función adecuada y para mantener la integridad biofísica de la película lagrimal. En consecuencia, las alteraciones en su equilibrio generan cambios en la homeostasis de la superficie ocular, manifestando diversas afecciones, como ojo seco, blefaritis, entre otras (24).
Gracias a la composición molecular del fluido lagrimal se ha propuesto la presencia de ciertos biomarcadores, tanto para enfermedades oculares como sistémicas. Se han obtenido ventajas en la lágrima mediante la aplicación de técnicas en biología celular y molecular para la identificación y expresión diferencial de diversas moléculas (genes, factores de transcripción, metabolitos y proteínas) que presentan un rol importante en patologías oculares, como ojo seco, conjuntivitis alérgica, glaucoma, queratocono y enfermedades sistémicas como diabetes, cáncer y neurodegeneración (24,25).
De acuerdo con lo anterior, se puede hablar de la EOS como una alteración de la (UFL); además se cataloga como una condición inflamatoria crónica en la que el imbalance de la respuesta inmunológica modula el daño en la superficie interpalpebral, presentando molestias que afectan negativamente la visión, ya sea por daños u otros problemas fisiológicos. La UFL juega un papel regulador en la secreción y formación de la película lagrimal además mantiene la fisiología normal de la superficie ocular (compuesto por córnea, conjuntiva, glándula lagrimal, glándula de Meibomio, párpados, nervios sensoriales y motores); además, las fibras nerviosas son importantes en el mantenimiento de la función normal de la córnea y la integridad de la UFL (26).
Entre los factores de riesgo para padecer EOS se encuentran actividades diarias que disminuyan la cantidad de veces que se parpadea, como el uso de computadoras, estudiar u otra actividad de concentración, también el uso de lentes de contacto, enfermedades del tejido conectivo, el trasplante de médula ósea, la radioterapia, DM, dieta baja en omega 3, deficiencia de vitamina A, uso de medicamentos y cirugía refractiva (3).
La prevalencia de aparición aumenta de forma dramática con la edad, lo que va de la mano con el aumento de la población adulta mayor, por lo que es una causa importante de morbilidad ocular a nivel mundial. Un resumen global de la información disponible sugiere que la prevalencia se oscila entre 5-30 % de la población por encima de los 50 años de edad (27).
Ojo seco y su asociación con diabetes
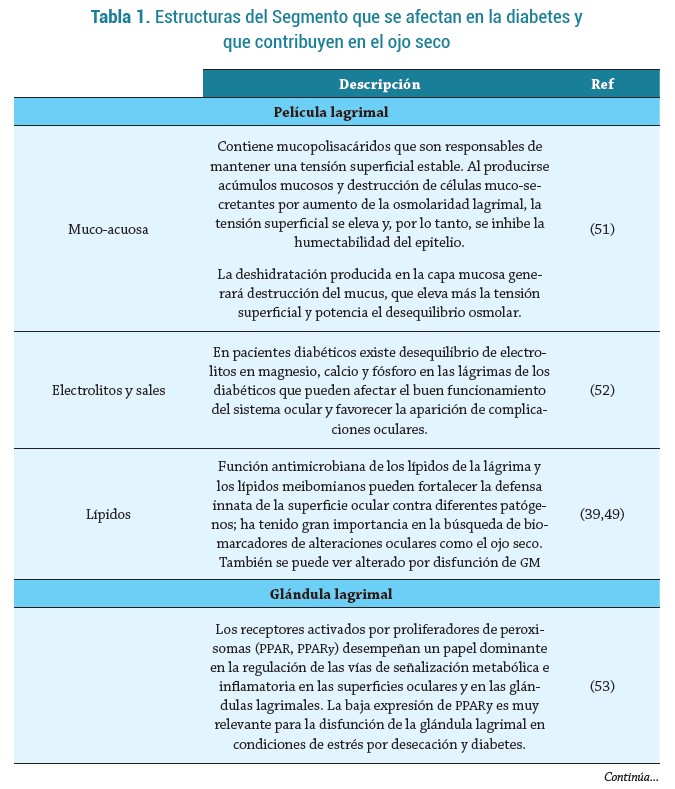
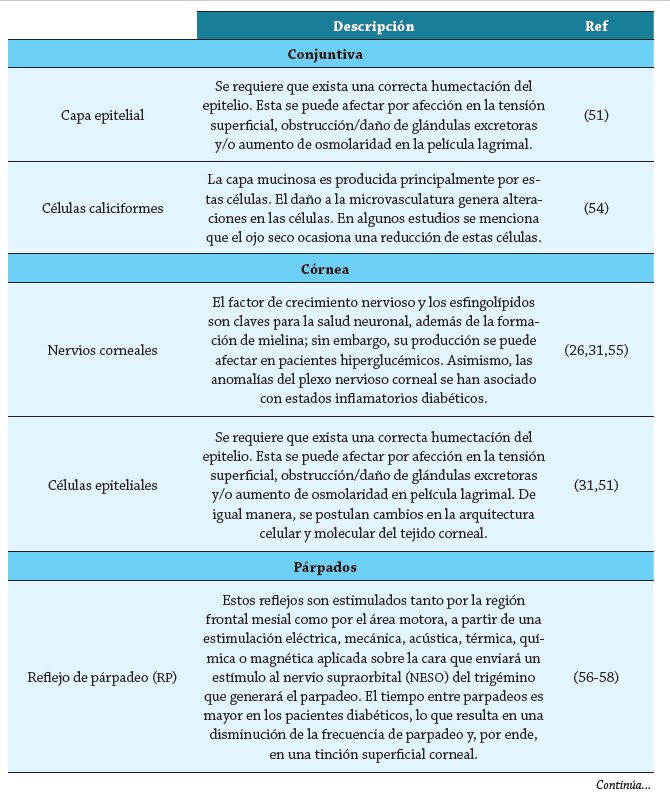
Es importante conocer que la diabetes, especialmente la tipo 2 genera varias afecciones oculares. Manaviat et al. informaron que la prevalencia de EOS era del 54,3 % en pacientes con DM tipo 2 y que la tasa de morbilidad era mucho más alta que en sujetos no diabéticos (28), en consecuencia, las alteraciones en la superficie ocular suelen ser comunes en individuos con DM (tabla 1).
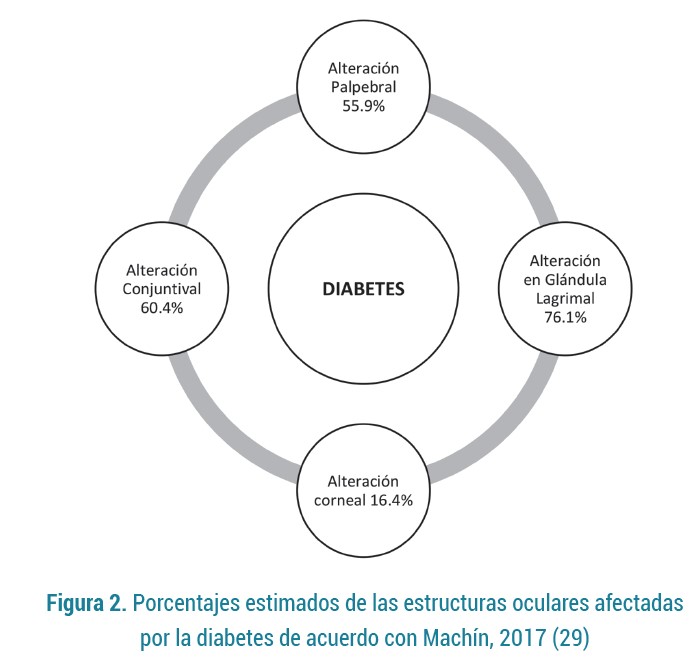
De igual manera, Machín (2017) sugirió que en la DM tipo 2, las estructuras oculares más afectadas debido a esta patología sistémica son la glándula lagrimal (76.1 %) y en segundo lugar la conjuntiva (60.4 %), que han demostrado una gran prevalencia de disfunción en la producción lagrimal (29) (Figura 2). Además, se ha descrito la existencia de un alto porcentaje de prevalencia de DM en mujeres y personas mayores de 50 años, no obstante, se menciona que en muchos casos no se suele relacionar la edad ni el género, con la prevalencia de DM (2). De acuerdo con lo anterior, las personas con DM tienen más probabilidades de sufrir la enfermedad de ojo seco, especialmente aquellas que no están adheridas a un tratamiento, lo cual induce un incremento en la glucemia que da como resultado una repercusión mayor en las glándulas implicadas en la producción de lágrimas (29).
Los pacientes diabéticos se quejan con frecuencia de síntomas típicos del ojo seco, como ardor y sensación de cuerpo extraño. Los hallazgos clínicos más frecuentes y medibles son: la secreción lagrimal reducida, la inestabilidad de la película lagrimal y la reducción de la sensación corneal. La afectación de las demás estructuras son determinantes en la etiología del ojo seco, ya que van a causar un aumento en la osmolaridad de la lágrima e inflamación de la superficie ocular, lo cual se produce por causa de la inflamación en la glándula lagrimal reduce la estabilidad y equilibrio de la lágrima, lo cual disminuye la protección natural de la superficie ocular 30.
Uno de los hallazgos clínicos oculares, en relación con la DM, es la pérdida de la sensibilidad corneal; esto asociado a la hiperglicemia crónica, que aumenta los productos finales de glucosilación avanzada (AGE, en sus siglas en inglés), promueve el daño en el nervio trigémino e induce cambios en las fibras nerviosas A-5 y C que puede resultar en alteraciones en el proceso de reparación epitelial 31. En efecto, Sahin et al. encontraron en un grupo de individuos con DM que la histéresis corneal disminuyó significativamente comparado con un grupo control (32). Lo cual podría ser tenido en cuenta durante el diagnóstico y seguimiento de la DM. En consecuencia, estudios como el de Hager et al. y Abusharha et al. sugieren que la evaluación corneal y lagrimal sean medidores clínicos de la severidad o progresión de la DM (33,34).
Por otro lado, se ha encontrado que la diabetes mellitus llega a reducir la capa lipídica. Según Han et al. esto se debe a una identificación de insulina en la película lagrimal y la presencia de receptores de esta y factor de crecimiento insulina-like-1 (IGF-1) en la superficie ocular humana (35). También es relevante conocer que algunos factores de crecimiento previamente identificados como promotores del crecimiento epitelial (factores de crecimiento epidérmico y nervioso) comparten mecanismos similares de transducción de señal con insulina. En adición, el estudio realizado por Zhang et al. encontró que los patrones del proteoma lagrimal de los pacientes diabéticos son muy diferentes en el número y la intensidad que la de los sujetos sanos y que las alteraciones en las lágrimas diabéticas se correlacionaron con la duración de la enfermedad diabética (36).
Es importante resaltar que los lípidos que mantienen a la superficie ocular sana derivan tanto de la capa lipídica de la lágrima como de las glándulas de meibomio (GM), siendo estas última un target para la glucosa (37). Las GM están reguladas mediante la participación del sistema nervioso autónomo como somatosensorial, y existe evidencia de que son susceptibles a cambios en la expresión de hormonas, neuromediadores y además de la glucosa (38), por ejemplo, Wu et al. encontraron la presencia de disfunción de glándulas de Meibomio (DGM) en individuos con DM y dicha disfunción se relacionó con los niveles elevados de HbA1C y la duración de la DM (39). Por otro lado, en modelo murino diabético, Guo et al. encontraron una mayor pérdida de acinos de las glándulas de meibomio (GM), activación de vías de señalización inflamatoria y de estrés oxi-dativo, que posterior al tratamiento con metformina dichos cambios en las GM se redujeron (40).
Lo anterior pone de manifiesto que el abordaje de un paciente diabético desde la medicina preventiva podría ser más que una detección temprana de retinopatía diabética, sino que la inclusión de un análisis de las estructuras de la superficie ocular podría relacionarse con el estado metabólico del individuo.
Por tal razón, varias investigaciones no solo han considerado la película lagrimal, como un fluido interesante para evaluar algunos biomarcadores de la DM, sino que ponen énfasis en algunas alteraciones que se pueden presentar en la superficie ocular y que contribuyen al desarrollo de ojo seco (19). En este sentido, análisis invitro han demostrado que distintos tipos celulares en la superficie ocular requieren de una actividad metabólica de glucosa adecuada, y al generar cambios en dicha condición contribuyen a distintivas vías de señalización celular que favorecen el estrés oxidativo, desregulación de la actividad del óxido nítrico, disfunción mitocondrial e inflamación ocular, eventos biológicos que se presentan en la DM (41,42).
De igual manera, en la diabetes, el daño a la microvasculatura que alimenta la glándula lagrimal junto con la neuropatía autónoma de la glándula lagrimal, que ocurren al principio de la diabetes, pueden contribuir a una función deficiente de la glándula. Lo anterior es respaldado por investigaciones como la de Misra et al., en la que demostraron que la actividad autonómica que propicia una adecuada producción lagrimal se ve disminuida en presencia de neuropatía diabética y que los niveles glicémicos elevados podrían contribuir a dicha falla en la producción lagrimal (43).
Asimismo, la presencia de la neuropatía llega a ocasionar disminución de la sensibilidad corneal, la cual es una manifestación clínica de la queratopatía diabética. Se puede decir que esta patología causa lesiones en la membrana epitelial corneal, cambios en la composición de la densidad y morfología celular corneal, y alteración en la expresión del proteoma lagrimal, lo cual ocasiona pérdida de la homeostasis de la película lagrimal, lo que puede conducir a EOS (18,26). Además, la reducción de la sensación corneal también puede expresar una reducción de la frecuencia de parpadeo y un aumento de la evaporación de las lágrimas (44).
Por otra parte, analizando otro estudio de Machín, evidencia que a los 30 años la producción lagrimal comienza a disminuir progresivamente hasta que llega a un punto crítico a los 45 años y es insuficiente a los 60 en situaciones o requerimientos normales; por dicha razón, se vuelve aún más común encontrar en personas diabéticas la presencia de ojo seco (29). En complemento, Zhang et al. demostraron que la diabetes modifica la secreción del fluido lagrimal, lo que sugiere que el control autónomo de la función de la glándula lagrimal puede verse comprometido por la neuropatía en pacientes con DM (36). También se puede hablar de que uno de los factores que influyen en la deficiencia del componente acuoso y lipídico de la película lagrimal relacionada al envejecimiento son los andrógenos que actúan en el tejido de la glándula lagrimal (por lo que las mujeres tienen un mayor riesgo al presentar bajos niveles de andrógenos) y sobre los receptores de la glándula de Meibomio. Lo anterior ha llamado la atención, ya que autores como Navarro et al. han sugerido una relación entre la deprivación de andrógenos y su rol en enfermedades metabólicas como la diabetes (45).
Interesantemente, Yazdani et al. describen en su estudio que existe una correlación entre los niveles de hemoglobina glicada (HbA1C) y la presencia de enfermedad del ojo seco reportada en un cuestionario de sintomatología ocular. Los autores reportaron que individuos con DM tipo 2 presentaron una mayor sintomatología (P=0,001) con respecto a los de tipo 1 (55 y 27 %, respectivamente) (46). De igual forma, Pellerano et al. determinaron la relación entre los niveles de insulina y su control, en la que la cantidad de lágrima disminuyó con el aumento de los niveles de la HbA1C respecto a la sintomatología ocular. Se reportó un incremento asociado al aumento de los niveles de Glicemia Basal (p=0.001) y HbA1C (47).
Sin embargo, Zhang et al. sugieren que los pacientes diabéticos no dependientes de la insulina están correlacionados con la disfunción de la película lagrimal, por lo que son personas susceptibles a presentar ojo seco, relacionado con prueba de rompimiento lagrimal invasiva alterada (36). Tal como lo demuestran otras investigaciones, en las que en individuos con DM tipo 2 se encuentran alteraciones en la estabilidad lagrimal, aumento de la osmolaridad lagrimal, disfunción de meibomio y alteraciones en el espesor de la capa lipídica (48-50).

Las lágrimas contienen una variedad de sustancias, incluyendo proteínas, lípidos, mucinas, sales y otras moléculas orgánicas, y se cree que las proteínas lagrimales tienen funciones claves en la protección de la superficie ocular (30). En complemento de lo anterior, Bing et al. en análisis de identificación de proteínas lagrimales de pacientes con DM y ojo seco, en comparación con el grupo control, encontraron un aumento en la expresión de proteínas relacionadas con la apoptosis, la inmunidad y la inflamación (60). En adición, el grosor de los lípidos lagrimales (especialmente la capa lipídica de la película lagrimal), la estabilidad, la sensibilidad corneal y la cantidad de lágrimas disminuyeron significativamente en pacientes con DM (35). Tomado en cuenta lo anterior, es posible pensar que el análisis del lipidoma lagrimal podría ser una estrategia de diagnóstico temprana en aquellos individuos que presenten DM.
Impacto del tratamiento antidiabético sobre la superficie ocular
Respecto a la terapia farmacológica existe una fuerte evidencia donde se demuestra el efecto que tienen algunos fármacos antidiabéticos orales sobre la superficie ocular. Por ejemplo, en un modelo animal diabético se demostró que posterior al uso de metformina, la vía de señalización MAPK mejoró su actividad, y esto se relacionó a una reducción en la expresión de mediadores inflamatorios y estrés oxidativo junto con la restauración de la morfología de las GM (40).
Por otro lado, recientes investigaciones que han descubierto los mecanismos biológicos asociados al desarrollo de neuropatía diabética y ojo seco ponen en evidencia posibles opciones terapéuticas que mejoran la condición ocular. En efecto, Ajith sugiere un efecto terapéutico del ácido alfa lipoico (ALA) sobre el ojo seco y la retinopatía diabética, lo anterior gracias a la reducción de marcadores inflamatorios como la metaloproteinasa 9 (MMP-9), y promueve la actividad antioxidante sobre la superficie ocular (61).
De igual manera, Hao y Ning evaluaron la actividad de un agonista del receptor del péptido 1 similar al glucagón (GLP-1RA) sobre la hiperglicemia, el control de peso e interesantemente sobre las estructuras de la superficie ocular, induciendo dicho agonista una mejora en la estabilidad de la película lagrimal (62). En consonancia con dicha propuesta terapéutica, McLaughlin et al. describen el uso de Naltrexona como bloqueador del factor del crecimiento opiode (OGF en sus siglas en ingles) para el tratamiento de ojo seco diabético que conlleva a una mejoría en la sensibilidad y reepitelización corneal (63).
A pesar de que gran parte de los estudios farmacológicos que abordan ojo seco y diabetes están en desarrollo experimental, podrían ser una promesa en un futuro muy cercano como una terapia que incluiría un abordaje mucho más específico en la enfermedad.
Futuras perspectivas
Conociendo que existe una relación entre la enfermedad de ojo seco y diabetes, en especial en las mujeres y personas mayores de 50 años, es importante para el profesional de la salud realizar una adecuada intervención en esta enfermedad, haciendo un diagnóstico diferencial en estos individuos.
El tema de los biomarcadores en los últimos años ha recobrado una gran importancia; esto sumado a que las nuevas técnicas de diagnóstico han permitido comprender los aspectos biológicos que intervienen en la diabetes y cómo estos pueden afectar la homeostasis de la superficie ocular, han surgido investigaciones en las que se busca evaluar los niveles de glicemia a partir de fluido lagrimal y otros marcadores de la enfermedad a partir de esta película, que servirá no solo para determinar el estado metabólico en los pacientes, sino para establecer grados de asociación entre la diabetes y el ojo seco. Un ejemplo de lo anterior es la aplicación de la ciencia ómica y la secuenciación de última generación a la investigación ocular y sistémica (64-67), con el objetivo de comprender la relación de la superficie ocular, su importancia en enfermedades tan relevantes como lo es la DM.
Se espera que este artículo genere interés y ayude a la continua exploración de este tema o de temas relacionados, como por ejemplo, la exploración de los biomarcadores de la película lagrimal en población diabética o explorar estas dos enfermedades en diferentes tipos de poblaciones, para seguir así profundizando la correlación entre estas dos.
CONCLUSIóN
Debido a la alta prevalencia de la diabetes tipo 2 y las afecciones que genera, especialmente oculares, se debe tener en cuenta los múltiples factores de riesgo, entre los cuales se destacan los niveles de estrógeno, que hacen más propensas a las mujeres y a personas mayores de 50 años, y ocasionan en esta población daños en las estructuras oculares que degradan la calidad visual y originan patologías como la enfermedad de ojo seco, que tiene repercusiones en la calidad de vida en general, ya que puede perjudicar el bienestar emocional, la productividad en el lugar de trabajo y otras actividades cotidianas; por lo que se requiere una detección y revisión constante en la calidad e integridad de la unidad funcional lagrimal para reducir el riesgo de sintomatología.
Contribución de los autores: Laura G. Páez, Miguel A. Culmán: describieron la problemática, realizaron las tablas y figura, revisaron las referencias bibliográficas del manuscrito; Timothy J. González: describió la problemática, diseño de tablas y figuras, y Sandra Carolina Durán C.: estructuración del manuscrito, revisión temática.
Financiación: ninguna.
Conflicto de interés: ninguno.
REFERENCIAS
1. Lozano JA. Diabetes Mellitus. Rev. Bras. Med. 2005; 62 (SPEC. ISS.): 60-71.
2. Vargas H, Casas Lá. Epidemiología de la diabetes en Sudamérica: La Experiencia de Colombia. Clin. e InvestigArter. 2016; 28 (5): 245-256.
3. Manrique Córdoba Quirós. Conociendo El Ojo Seco. Rev. Médica Costa Rica y Centroam. 2014; 1 (613): 811-816.
4. Samaniego Banuelos F. ¿De qué diabetes estamos hablando? Editorial Itaca, 2019.
5. Gea González M. Neuropatía Diabética. Rev Hosp Gral. 2002; 5 (1): 7-23.
6. Abad Pérez D, Bureo Dacal J C, Alborch Alborch J R, Corbatón Anchuelo A, Curz González I, Escribano Serrano J, Gracía Alegría, J, Gómez Huelgas R, González Sarmiento E, Hinojosa Mena-Bernal MC, Mi-chán Doña A, Sánchez Fuentes D, Sánchez Ledema M, Sánchez Rodríguez á, Serrano Ríos M, Suárez C, Real de Asúa D. Diabetes; 2010.
7. Rivera-García VH, Lascano-Tejada JM. Detección de Las Diferentes Enfermedades Oculares En Pacientes Diabéticos. 2017; 3 (1): 391-402.
8. Pajvani UB, Accili D. The New Biology of Diabetes. Diabetologia. 2015; 58 (11): 2459-2468. https://doi.org/10.1007/s00125-015-3722-5
9. Skyler JS, Bakris GL, Bonifacio E, Darsow T, Eckel RH, Groop L, Groop PH, Handelsman Y, Insel RA, Mathieu C, McElvaine AT, Palmer JP, Pugliese A, Schatz DA, Sosenko JM, Wilding JPH, Ratner RE. Differentiation of Diabetes by Pathophysiology, Natural History, and Prognosis. Diabetes. 2017; 66 (2): 241-255. https://doi.org/10.2337/db16-0806.
10. Stankov K, Benc D, Draskovic D. Genetic and Epigenetic Factors in Etiology of Diabetes Mellitus Type 1. Pediatrics. 2013; 132 (6): 1112-1122. https://doi.org/10.1542/peds.2013-1652.
11. Al-Goblan AS, Al-Alfi MA, Khan MZ. Mechanism Linking Diabetes Mellitus and Obesity. Diabetes. Metab. Syndr. Obes. 2014; 7: 587-591. https://doi.org/10.2147/DMSO.S67400.
12. Anjana RM, Mohan V. Diabetes and Physical Activity. The Indian Journal of Medical Research. 2016 April; 530-531. https://doi.org/10.4103/0971-5916.184295.
13. Maddatu J, Anderson-Baucum E, Evans-Molina C. Smoking and the Risk of Type 2 Diabetes. Transl. Res. 2017; 184: 101-107. https://doi.org/10.1016/j.trsl.2017.02.004.
14. Jia Y, Reddy MA, Das S, Oh HJ, Abdollahi M, Yuan H, Zhang E, Lanting L, Wang M, Natarajan R. Dysregulation of Histone H3 Lysine 27 Trimethylation in Transforming Growth Factor-B1-Induced Gene Expression in Mesangial Cells and Diabetic Kidney. J. Biol. Chem. 2019; 294 (34): 12695-12707. https://doi.org/10.1074/jbc.RA119.007575.
15. Feng J, Xing W, Xie L. Regulatory Roles of MicroRNAs in Diabetes. Int. J. Mol. Sci. 2016; 17 (10). https://doi.org/10.3390/ijms17101729.
16. Feng B, Ruiz MA, Chakrabarti S. Oxidative-Stress-Induced Epigenetic Changes in Chronic Diabetic Complications. Can. J. Physiol. Pharmacol. 2013; 91 (3): 213-220. https://doi.org/10.1139/cjpp-20120251.
17. Diedisheim M, Carcarino E, Vandiedonck C, Roussel R, Gautier JF, Venteclef N. Regulation of Inflammation in Diabetes: From Genetics to Epigenomics Evidence. Mol. Metab. 2020; 41: 101041. https://doi.org/10.1016/j.molmet.2020.101041
18. Lima-Fontes M, Barata P, Falcão M, Carneiro Â. Ocular Findings in Metabolic Syndrome: A Review. Porto Biomed. J. 2020; 5 (6): e104. https://doi.org/10.1097/j.pbj.0000000000000104.
19. Chopra R, Chander A, Jacob JJ. Ocular Associations of Metabolic Syndrome. Indian J. Endocrinol. Metab. 2012; 16 (Suppl1): S6-S11. https://doi.org/10.4103/2230-8210.94244.
20. Wong-Riley MTT. Energy Metabolism of the Visual System. Eye Brain. 2010; 2: 99-116. https://doi.org/10.2147/EB.S9078.
21. Dogru M, Kojima T, Simsek C, Tsubota K. Potential Role of Oxidative Stress in Ocular Surface Inflammation and Dry Eye Disease. Invest. Ophthalmol. Vis. Sci. 2018; 59 (14): DES163-DES168. https://doi.org/10.1167/iovs.17-23402.
22. Wang MX, Zhao J, Zhang H, Li K, Niu LZ, Wang YP, Zheng YJ. Potential Protective and Therapeutic Roles of the Nrf2 Pathway in Ocular Diseases: An Update. Oxid. Med. Cell. Longev. 2020: 9410952. https://doi.org/10.1155/2020/9410952.
23. Mrugacz M, Bryl A, Zorena K. Retinal Vascular Endothelial Cell Dysfunction and Neuroretinal Degeneration in Diabetic Patients. J. Clin. Med. 2021; 10 (3): 458. https://doi.org/10.3390/jcm10030458.
24. Durán S, Gómez Molina A. Biomarcadores En Película Lagrimal y Su Aplicación Clínica. Rev. Salud. Bosque. 2020; 10 (1): 53-63.
25. Fong P, Shih K, Lam P, Chan TY, Jhanji V, Tong L. Role of Tear Film Biomarkers in the Diagnosis and Management of Dry Eye Disease. Taiwan Journal of Ophthalmology. 2019; 150. https://doi.org/10.4103/tjo.tjo_56_19.
26. Del Buey MA, Casas P, Caramello C, López N, de la Rica M, Subirón A. B, Lanchares E, Huerva V, Gr-zybowski A, Ascaso FJ. An Update on Corneal Biomechanics and Architecture in Diabetes. J. Ophthalmol. 2019: 7645352. https://doi.org/10.1155/2019/7645352.
27. Smith JA, Albeitz J, Begley C, Caffery B, Nichols KellyçSchaumberg D, Schein O. La Epidemiología de La Enfermedad Del Ojo Seco: Informe Del Subcomité de Epidemiología Del Taller Internacional Sobre Ojo Seco (2007). Ocul. Surf. 2007; 5 (2): 96-111.
28. Manaviat MR, Rashidi M, Afkhami-Ardekani M, Shoja MR. Prevalence of Dry Eye Syndrome and Diabetic Retinopathy in Type 2 Diabetic Patients. BMC Ophthalmol. 2008; 8: 10. https://doi.org/10.1186/1471-2415-8-10.
29. Machín YF. Manifestaciones Oftalmológicas En Pacientes Diabéticos de Un área de Salud. Rev. Cubana Oftalmol. 2017; 30 (1): Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-21762017000100005&lng=es.
30. Machín Yey F. Síndrome de ojo seco en pacientes diabéticos de un área de salud. Rev. Cubana Of-talmol. 2017; 30 (2):1-12. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-21762017000200004&lng=es.
31. Zhao H, He Y, Ren YR, Chen BH. Corneal Alteration and Pathogenesis in Diabetes Mellitus. Int. J. Ophthalmol. 2019; 12 (12): 1939-1950. https://doi.org/10.18240/ijo.2019.12.17.
32. Sahin A, Bayer A. Corneal Hysteresis Changes in Diabetic Eyes. J. Cataract Refract. Surg. 2010; 36 (2): 361. https://doi.org/10.1016/j.jcrs.2009.08.025.
33. Hager A, Wegscheider K, Wiegand W. Changes of Extracellular Matrix of the Cornea in Diabetes Me-llitus. Graefe's Arch. Clin. Exp. Ophthalmol. = Albr. von Graefes Arch. fur Klin. und Exp. Ophthalmol. 2009; 247 (10): 1369-1374. https://doi.org/10.1007/s00417-009-1088-4.
34. Abusharha A, Alsaqar A, Fagehi R, Alobaid M, Almayouf A, Alajlan S, Omair M, Alahmad E, Masmali A. Evaluation of Tear Film Osmolarity Among Diabetic Patients Using a TearLab Osmometer. Clin. Optom. 2021; 13: 257-261. https://doi.org/10.2147/OPTO.S325768.
35. Han SB, Yang HK, Hyon J. Y. Influence of Diabetes Mellitus on Anterior Segment of the Eye. Clinical Interventions in Aging. Dove Medical Press Ltd. 2019: 53-63. https://doi.org/10.2147/CIA.S190713.
36. Zhang X, Zhao L, Deng S, Sun X, Wang N. Dry Eye Syndrome in Patients with Diabetes Mellitus: Prevalence, Etiology, and Clinical Characteristics. J. Ophthalmol. 2016; 22 (1): 1-6. https://doi.org/10.1155/2016/8201053.
37. Ding J, Liu Y, Sullivan DA. Effects of Insulin and High Glucose on Human Meibomian Gland Epithelial Cells. Invest. Ophthalmol. Vis. Sci. 2015; 56 (13): 7814-7820. https://doi.org/10.1167/iovs.15-18049.
38. Cox SM, Nichols JJ. The Neurobiology of the Meibomian Glands. Ocul. Surf. 2014; 12 (3): 167-177.https://doi.org/10.1016/j.jtos.2014.01.005.
39. Wu H, Fang X, Luo S, Shang X, Xie Z, Dong N, Xiao X, Lin Z, Liu Z. Meibomian Glands and Tear Film Findings in Type 2 Diabetic Patients: A Cross-Sectional Study. Front. Med. 2022; 9: 762493. https://doi.org/10.3389/fmed.2022.762493
40. Guo Y, Zhang H, Zhao Z, Luo X, Zhang M, Bu J, Liang M, Wu H, Yu J, He H, Zong R, Chen Y, Liu Z, Li W. Hyperglycemia Induces Meibomian Gland Dysfunction. Invest. Ophthalmol. Vis. Sci. 2022; 63 (1): 30. https://doi.org/10.1167/iovs.63.1.30.
41. Al-Enezi M, Al-Saleh H, Nasser M. Mitochondrial Disorders with Significant Ophthalmic Manifestations. Middle East Afr. J. Ophthalmol. 2008; 15 (2): 81-86. https://doi.org/10.4103/0974-9233.51998.
42. Liu H, Sheng M, Liu Y, Wang P, Chen Y, Chen L, Wang W, Li B. Expression of SIRT1 and Oxidative Stress in Diabetic Dry Eye. Int. J. Clin. Exp. Pathol. 2015; 8 (6): 7644-7653.
43. Misra SL, Patel D V, McGhee CNJ, Pradhan M, Kilfoyle D, Braatvedt G, D, Craig JP. Peripheral Neuropathy and Tear Film Dysfunction in Type 1 Diabetes Mellitus. J. Diabetes Res. 2014; 848659. https://doi.org/10.1155/2014/848659
44. Zou X, Lu L, Xu Y, Zhu J, He J, Zhang B, Zou H. Prevalence and Clinical Characteristics of Dry Eye Disease in Community-Based Type 2 Diabetic Patients: The Beixinjing Eye Study. BMC Ophthalmol. 2018; 18 (1):117 . https://doi.org/10.1186/s12886-018-0781-7.
45. Navarro G, Allard C, Xu W, Mauvais-Jarvis F. The Role of Androgens in Metabolism, Obesity, and Diabetes in Males and Females. Obesity. Blackwell Publishing Inc.; 2015. P. 713-719. https://doi.org/10.1002/oby.21033.
46. Yazdani-Ibn-Taz MK, Han MM, Jonuscheit S,.; Collier A, Nally JE, Hagan S. Patient-Reported Severity of Dry Eye and Quality of Life in Diabetes. Clin. Ophthalmol. 2019; 13: 217-224. https://doi.org/10.2147/OPTH.S184173.
47. Pellerano FM. Relationship between Glycemic Control and Dry Eye Syndrome in Diabetic Patients. Dominic. Repub. 2016; 11 (6): 20-33.
48. Huerva V, Ascaso FJ, Grzybowski A. Diabetic Ocular Surface and Anterior Segment Pathology. Journal of ophthalmology. 2019: 5951398. https://doi.org/10.1155/2019/5951398.
49. Shamsheer RP, Arunachalam CA Clinical Study of Meibomian Gland Dysfunction in Patients with Diabetes. Middle East Afr. J. Ophthalmol. 2015; 22 (4): 462-466. https://doi.org/10.4103/09749233.167827.
50. Eissa IM, Khalil NM, El-Gendy HAA Controlled Study on the Correlation between Tear Film Volume and Tear Film Stability in Diabetic Patients. J. Ophthalmol. 2016: 5465272. https://doi.org/10.1155/2016/5465272.
51. Aguilar A J. Tears Osmolarity in Dry Eye. Arq. Bras. Oftalmol. 2009; 71 (6 SUPP): 69-71. https://doi.org/10.1590/s0004-27492008000700014.
52. Okukpon J, Okukpon O. Tear Electrolyte Assessment of Diabetic Patients in Southern Nigeria. Afr. Health Sci. 2019; 19 (4): 2839-2845. https://doi.org/10.4314/ahs.v19i4.5.
53. Mu PY, Chu CC, Yu D, Shao Y, Zhao SZ. PPARy: The Dominant Regulator among PPARs in Dry Eye Lacrimal Gland and Diabetic Lacrimal Gland. Int. J. Ophthalmol. 2020; 13 (6): 860-869. https://doi.org/10.18240/ijo.2020.06.02.
54. Luna-Martínez I, Aguilar-Montes G, del Rocío Estrada-Hernández M, Reyes-Castro MM. Hallazgos Histopatológicos En Biopsia Conjuntival En Pacientes Con Síndrome de Ojo Seco. Rev. Mex. Oftalmol. 2012; 86 (4): 191-196.
55. Monzón Cárdenas L. Influence of Diabetes Mellitus in the Ocular Surface Introducción. Rev. Cuba. Oftalmol. 2019; 32 (4): 1-12.
56. León-Sarmiento FE, Gutiérrez C, Bayona-Prieto J. Evaluación neurofuncional del tallo cerebral. Parte I: Reflejo del parpadeo. Iatreia. 2009: p. 372-381.
57. Francés AT, Ronda-Pérez E, Del Mar Seguí Crespo M. Alteraciones oculares y visuales en personas que trabajan con ordenador y son usuarias de lentes de contacto: Una revisión bibliográfica. Revista Española de Salud Pública. 2014: 203-215. https://doi.org/10.4321/S1135-57272014000200004.
58. Inoue K, Okugawa K, Amano S, Oshika T, Takamura E, Egami F, Umizu G, Aikawa K, Kato S. Blinking and Superficial Punctate Keratopathy in Patients with Diabetes Mellitus. Eye (Lond). 2005; 19 (4): 418-421. https://doi.org/10.1038/sj.eye.6701497.
59. Forero L. G. Actividad Neurogénica en el ojo seco. Cien, Tecnol. Salud, Vis. Ocul. 2015; 1 (1): 1-10.
60. Li B, Sheng M, Xie L, Liu F, Yan G, Wang W, Lin A, Zhao F, Chen Y. Tear Proteomic Analysis of Patients with Type 2 Diabetes and Dry Eye Syndrome by Two-Dimensional Nano-Liquid Chromatography Coupled with Tandem Mass Spectrometry. Investig. Ophthalmol. Vis. Sci. 2014; 55 (1): 177-186. https://doi.org/10.1167/iovs.13-12080.
61. Ajith TA. Alpha-Lipoic Acid: A Possible Pharmacological Agent for Treating Dry Eye Disease and Retinopathy in Diabetes. Clin. Exp. Pharmacol. Physiol. 2020; 47 (12): 1883-1890. https://doi.org/https://doi.org/10.1111/1440-1681.13373.
62. Hao Y, Wei M, Zhang N, Zhang X. Novel Glucagon-like Peptide-1 Analogue Exhibits Potency-Driven G-Protein Biased Agonism with Promising Effects on Diabetes and Diabetic Dry Eye Syndrome. Bioengineered. 2022; 13 (3): 5467-5479. https://doi.org/10.1080/21655979.2022.2031418.
63. McLaughlin PJ, Sassani JW, Zagon IS. Naltrexone as a Novel Therapeutic for Diabetic Corneal Complications. J. Cell. Immunol. 2020; 2 (2): 42-46. https://doi.org/10.33696/immunology.1.018.
64. Patel A, Hayward JD, Tailor V, Nyanhete R, Ahlfors H, Gabriel C, Jannini TB, Abbou-Rayyah Y, Henderson R, , KK, Islam L, Bitner-Glindzicz M, Hurst J, Valdivia LE, Zanolli M, Moosajee M, Brookes J, Papadopoulos M, Khaw PT, Cullup T, Jenkins L, Dahlmann-Noor A, Sowden JC. The Oculome Panel Test: Next-Generation Sequencing to Diagnose a Diverse Range of Genetic Developmental Eye Disorders. Ophthalmology. 2019; 126 (6): 888-907. https://doi.org/10.1016/j.ophtha.2018.12.050.
65. Donath X, Saint-Martin C, Dubois-Laforgue D, Rajasingham R, Mifsud F, Ciangura C, Timsit J, Bellan-né-Chantelot C. Next-Generation Sequencing Identifies Monogenic Diabetes in 16 % of Patients with Late Adolescence/Adult-Onset Diabetes Selected on a Clinical Basis: A Cross-Sectional Analysis. BMC Med. 2019; 17 (1): 132. https://doi.org/10.1186/s12916-019-1363-0.
66. Nasykhova Y A, Barbitoff YA, Serebryakova EA, Katserov DS, Glotov AS. Recent Advances and Perspectives in next Generation Sequencing Application to the Genetic Research of Type 2 Diabetes.cWorld J. Diabetes. 2019; 10 (7): 376-395. https://doi.org/10.4239/wjd.v10.i7.376.
67. Tummanapalli SS, Willcox MDP, Issar T, Yan A, Pisarcikova J, Kwai N, Poynten AM, Krishnan AV, Markoulli M. Tear Film Substance P: A Potential Biomarker for Diabetic Peripheral Neuropathy. Ocular Surface. 2019. P. 690-698. https://doi.org/10.1016/j.jtos.2019.08.010.