Fecha de recepción: junio 1 de 2022 Fecha de aceptación: enero 19 de 2023
ARTíCULO DE REVISIóN https://dx.doi.org/10.14482/sun.39.03.519.515
Los desafíos de la nueva variante ómicron para la salud pública: una revisión de la literatura actual
The challenges of the new omicron variant for public health: a review of the current literature
Lorena Vásquez Ortiz1, Constanza Neri Morales2, Andrés Felipe Cruz González3, Magda Ximena Urrea Martínez4, Paula Andrea Martínez Medina5, Juan Jerónimo Ortega Rocha6, Rubén Darío Martínez Báez7, Luis Gustavo Celis Regalado8
Semillero de Investigación en Terapia Celular y Metabolismo, Facultad de Medicina, Universidad de La Sabana, Chía (Colombia).
1 Médico general, Universidad de La Sabana. Investigadora asociada. CvLAC:https://scienti.minciencias.gov.co/cvlac/visualizador/generarCurriculoCv.do?cod_ rh=0002001430 lorenavaor@unisabana.edu.co
2 Médico interno, Universidad de La Sabana. Investigadora asociada. Orcid: https://orcid.org/0000-0002-1785-0832. CvLAC: https://scienti.minciencias.gov.co/cvlac/visualizador/generarCurriculoCv.do?cod_rh=0001753245 constanzane@unisabana.edu.co
3 Médico general, Universidad de La Sabana. Investigador asociado. Orcid: https://orcid.org/0000-0001-9660-7090 . CvLAC: https://scienti.minciencias.gov.co/cvlac/visualizador/generarCurriculoCv.do?cod_rh=0000039401 andrescrgo@unisabana.edu.co.
4 Médica general, Universidad de La Sabana. Investigadora asociada. Orcid: https://orcid.org/0000-0001-7790-9018. CvLAC: https://scienti.minciencias.gov.co/cvlac/visualizador/generarCurriculoCv.do?cod_rh=0002002033. magdaurrma@unisabana.edu.co
5 Médico general, Universidad de La Sabana. Investigadora asociada. Orcid: 0000-0002-3379-4762. paulamarme@unisabana.edu.co
6 Estudiante de medicina, Universidad de La Sabana. Investigador asociado. Orcid: 0000-0001-7459-6829. CvLAC: https://scienti.minciencias.gov.co/cvlac/visualizador/generarCurriculoCv.do?cod_rh=0001840325 . juanortro@unisabana.edu.co
7 Estudiante de Medicina- Universidad de La Sabana. Investigador asociado. rubenmaba@unisabana.edu.co. Orcid: https://orcid.org/0000-0003-2199-5564. CvLAC: https://scienti.minciencias.gov.co/cvlac/visualizador/generarCurriculoCv.do?cod_rh=0001874362.
8 Biólogo investigador. Curso de Especialización en Inmunología, Especialista en Inmunología, especialista en Bioética, especialista en Prospectiva y Estrategia Organizacional, maestría en Biología con énfasis en Genética Humana. CvLAC: 0000344761201005302460. Teléfono: (601) 861 5555 / 861 6666. luis.celis@unisabana.edu.co
Correspondencia: Luis Gustavo Celis Regalado. Campus del Puente del Común, Km 7, Autopista Norte de Bogotá. Chía, Cundinamarca(Colombia). Departamento de Biociencias. Teléfono: (601) 861 5555 / 861 6666. luis.celis@unisabana.edu.co
RESUMEN
Introducción: Tras la pandemia del coronavirus del síndrome respiratorio agudo grave tipo 2 (SARS-Cov-2), múltiples variantes dentro de la estructura molecular del virus se han venido presentando, las cuales pueden condicionar mayores tasas de contagio, aumento de la morbimortalidad, disminución en la efectividad de las vacunas y manejos farmacológicos. La variante ómicron, clasificada como variante preocupante (VOC), ha demostrado hasta ahora tener mayor transmisibilidad y una respuesta diferente frente a la vacunación y los esquemas terapéuticos ya instaurados.
Objetivo: Describir la variante ómicron y su impacto sobre la transmisibilidad y mortalidad.
Métodos: Revisión de la literatura, en las bases de datos PubMed y Scopus, incluyendo estudios empíricos en inglés y español. De la bibliografía obtenida se utilizaron y analizaron detalladamente 49 artículos.
Resultados: Los resultados obtenidos nos permiten identificar los diferentes aspectos de la variante ómicron, desde su estructura molecular, transmisibilidad hasta su manejo actual y la efectividad de las vacunas contra la misma.
Conclusiones: En la actualidad, la variante ómicron ha constituido un desafío para el sistema de salud por su alta transmisibilidad. Sin embargo, los esfuerzos terapéuticos han demostrado un impacto en severidad y curso de la enfermedad.
Palabras clave: SARS-Cov-2, variante, ómicron, vacunas, proteína espiga.
ABSTRACT
Introduction: Since the pandemic of severe acute respiratory syndrome type 2 coronavi-rus (SARS-Cov-2), multiple variants within the molecular structure of the virus have been appearing, which may lead to higher infection rates, increased morbidity, and mortality, decreased effectiveness of vaccines and pharmacological management. The Omicron variant, classified as variant of concern (VOC) has so far shown higher transmissibility and a different response to vaccination and therapeutic regimens.
Objective: To describe the Omicron variant and its impact on transmissibility and mortality.
Methods: Literature review in PubMed and Scopus databases, including empirical studies in English and Spanish. From the bibliography obtained, 49 articles were used and analyzed in detail.
Results: The results obtained allow us to identify the different aspects of the Omicron variant, from its molecular structure, transmissibility to its current management and the effectiveness of vaccines against it.
Conclusions: Currently, the Omicron variant has constituted a challenge for the health system due to its high transmissibility. However, therapeutic efforts have shown an impact on the severity and course of the disease.
Keywords: SARS-Cov-2, variant, omicron, vaccines, spike protein.
INTRODUCCIóN
Desde el inicio de la pandemia del coronavirus del síndrome respiratorio agudo grave tipo 2 (SARS-Cov-2), grandes retos en salud pública se han generado debido a la gran transmisibilidad y morbimortalidad de este virus. Los esfuerzos científicos se han centrado, por más de dos años, en comprender su estructura, fisiopatología, controlar la transmisión, tener un manejo farmacológico adecuado, al igual que generar un esquema de vacunación efectivo. Tras la evolución de la pandemia, diversas mutaciones dentro de la estructura molecular del virus han comenzado a surgir, llevando a la creación de diversas variantes. Estas mutaciones comenzaron su aparición en marzo de 2020, en la proteína espiga, alterando su estructura y su interacción con el receptor humano de la enzima convertidora de angiotensina 2 (ACE2) (1).
Una variante se genera cuando una población de coronavirus adquiere una o varias de las mismas mutaciones, donde estas empiezan a adquirir ventajas sobre la replicación viral y transmisibilidad, presentando diversos obstáculos en la efectividad de los tratamientos y vacunas, al igual que un aumento de casos reportados (1). Las variantes se han clasificado dentro de cuatro grandes grupos: las variantes bajo monitoreo (VBM), variantes preocupantes (VOC), variantes de interés (VOI) y variantes con alta consecuencia (VOHC). Para el virus del SARS-Cov-2, se ha utilizado la clasificación VBM y VOC. Se define las variantes preocupantes (VOC) como aquellas que resultan las más críticas debido a su mayor capacidad de transmisibilidad, mayor virulencia, aumento de la morbimortalidad y disminución sobre la efectividad del manejo farmacológico y de las vacunas. Las variantes que hacen parte de las VBM son la alfa (B.1.1.7), beta (B.1.351), gamma (P.1), épsilon (B.1.427 y B.1.429), eta (B.1.525), iota (B.1.526), kappa (B.1.617.1), mu (B.1.621, B.1.621.1) y zeta (P.2). Las actuales VOC son la delta (B.1.617.2) y ómicron (B.1.1.529) (2,3).
La variante ómicron es la variante más reciente del SARS-CoV-2; su primer caso detectado fue en Suráfrica en noviembre de 2021 (4,5) . Esta variante ha generado un gran impacto en los sistemas de salud a nivel mundial debido al aumento de las tasas de contagio identificadas, mayor transmisibilidad y gastos para el sistema de salud. Esta revisión se enfoca en la variante ómicron, sus efectos sobre el organismo y tratamientos ya establecidos para la enfermedad por coronavirus 2019 (COVID-19).
METODOLOGíA
Se realizó una revisión de la literatura en las bases de datos de PubMed y Scopus, en la que se incluyeron estudios empíricos (experimentales u observacionales), publicados en inglés y español, y correspondientes al periodo de tiempo desde enero 2020 a mayo 2022. Se diseñó una estrategia de búsqueda basada en términos Mesh para PubMed y Scopus, estos fueron: ("SARS-CoV-2 variants" [Supplementary Concept] OR "SARS-CoV-2 variants" [Supplementary Concept] OR "Omicron" OR "Omi-cron"[Title] OR "Omicron variant"[Title]) AND ( "Vaccines"[Mesh] OR "Vaccines" OR "Vaccine"[Title] OR "Vaccine Potency"[Mesh] OR "2019-nCoV Vaccine mRNA-1273"[Mesh] OR "BNT162 Vaccines-Mesh]). De La bibliografía obtenida se utilizaron 49 artículos que fueron revisados en su totalidad por todos los autores.
RESULTADOS
Tras la revisión detallada de los artículos selectos, se subdividió la información en los diferentes aspectos de la variante ómicron: estructura molecular, transmisibilidad, patogenia y la efectividad de los regímenes de tratamiento y vacunas establecidos para Covid-19.
DISCUSIóN
Estructura Molecular
La variante ómicron ha sido la última variante en ser declarada como VOC (6,7) en el marco de la pandemia por SARS-CoV2; esto se debe a que ha demostrado ser cinco veces más infecciosa que la variante original y el doble que la variante delta. La nueva variante cuenta con una configuración similar a las anteriores variantes del virus, conformada por 4 proteínas principales: membrana (M), nucleocápside (N), envoltorio (E) y espiga (S) (8).
La proteína espiga juega un papel fundamental, debido a que es el sitio de acción de las vacunas y los anticuerpos; está formada por dos subunidades, denominadas S1, la cual está encargada de la unión al receptor de la célula huésped (RBD), y S2, que facilita la fusión de las membranas viral y celular. Entre estas subunidades se encuentra una hendidura que, tras la unión al receptor, fomenta cambios conformacionales irreversibles que optimizan la fusión de las membranas (9,10).
Se han encontrado 36 mutaciones en la proteína espiga (S), lo que se traduce en una variabilidad importante con respecto a la capacidad de evasión inmunitaria (11). Estas incluyen deleciones e inserciones, de las cuales 13 son totalmente nuevas y las restantes son rasgos previamente hallados en otras variantes preocupantes (6,12,13), como la mutación en el residuo 484, en la que se sustituye un ácido glutámico por una lisina (E484K), la cual se ha encontrado en las variantes Gamma y Beta, pero en la variante ómicron se sustituye por una alanina, es decir, se sustituye un aminoácido hidrofílico por uno hidrofóbico, lo cual altera la unión al RBD (14).
Así mismo, en la variante ómicron también se describió la mutación N501Y, que sustituye una aspa-ragina por una tirosina, mutación ya descrita en las variantes Alfa, Beta y Gamma, por lo que ha sido previamente estudiada y se conoce su influencia en el aumento de la unión del virus al receptor ACE2 humano (11). No obstante, se debe mencionar que la variante ómicron tiene 5.5 a 11 veces mayor tasa de mutación en el sitio de unión al receptor, siendo las mutaciones más importantes las T478K, E484A, Q493R y N501Y, debido a que confieren mayor afinidad al receptor humano (14).
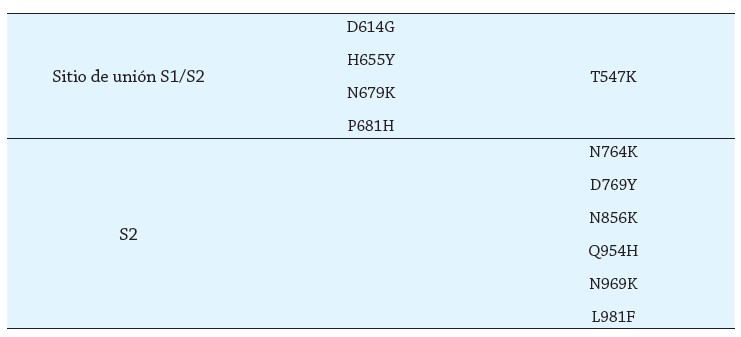
Las diferentes mutaciones de la nueva variante se distribuyen de la siguiente manera: 10 mutaciones en el dominio n-terminal de la proteína S 15 mutaciones en el dominio de unión al receptor de la misma proteína; 6 mutaciones en la subunidad S2 y 5 mutaciones más entre el sitio de unión al receptor y la hendidura entre S1/S2 (12), como se observa en la tabla 1. Esto permite no solo mayor transmisibilidad, afinidad por el receptor diana, en este caso el receptor de la ACE2- y escape inmune (6,12), sino también mayor expresión de la proteína S y menor capacidad de unión de los anticuerpos a las moléculas virales (12).
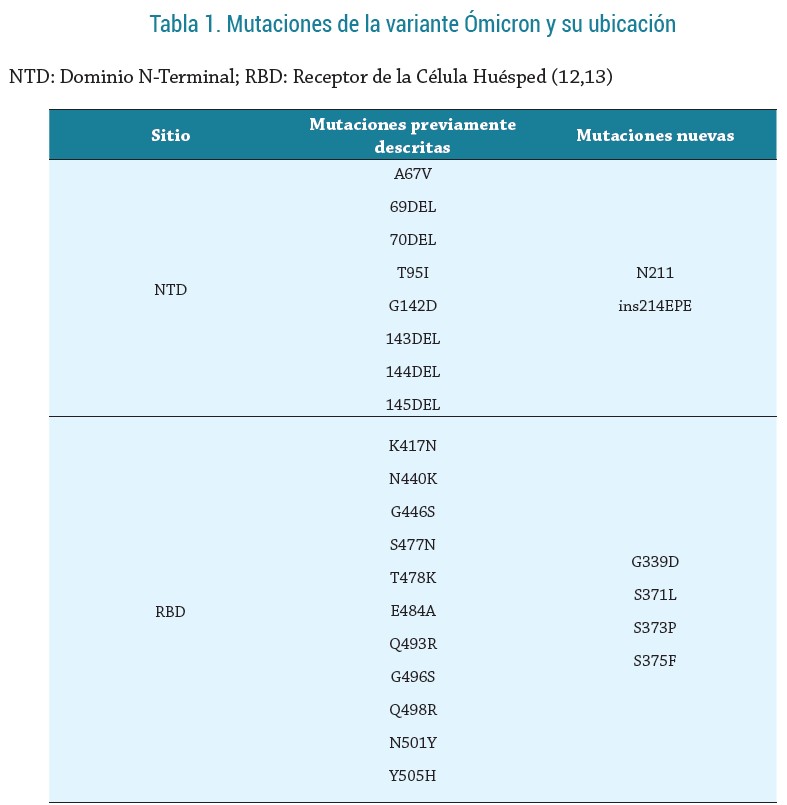
Adicionalmente, desde la aparición de la variante ómicron han emergido distintos sublinajes. Recientemente apareció la subvariante BA.2, identificada en Dinamarca, cuya prevalencia desde su idntificacion,ha aumentado de 0,1 a 89,2 %. No obstante, hasta el momento, no se han demostrado diferencias estadísticamente significativas en comparación con la subvariante BA.1 respecto a reinfección o muertes. Desde el punto de vista genético, se han encontrado 39 mutaciones en esta subvariante en comparación con la BA.1. Con respecto a la proteína S, específicamente, se hallaron 6 mutaciones y 3 depleciones, de las cuales 3 se encuentran en el RBD, exactamente en los residuos 371 y 142-145 (15).
Transmisibilidad
Aunque aún existe poca información concerniente a la variante ómicron en la literatura, es necesario continuar realizando estudios para definir exactamente la complejidad de esta; hasta ahora se sabe que las mutaciones presentes y previamente mencionadas en este artículo, le confieren mayor transmisibilidad (16). Prueba de esto es la expansión importante que ha logrado esta variante en Sudáfrica a pesar de la rápida transmisión y los altos niveles de inmunidad natural dejados por la variante Delta (6).
Se cree que lo anterior ha estado influenciado por las partículas virales exhaladas durante la respiración por los pacientes infectados, que en el caso de ómicron continúan siendo liberadas al ambiente hasta 2 semanas tras el inicio de los síntomas sin disminución en la cantidad de partículas de virus exhaladas (16).
Adicionalmente, se han realizado análisis del tropismo celular de ómicron para evaluar cómo las mutaciones en la proteína espiga han influido en la interacción con las células huésped, lo cual permitió conocer el mayor tropismo de ómicron por células pulmonares humanas, es decir, esta VOC se une de forma adecuada a los receptores humanos de la ACE2 y logra demostrar que las diferentes mutaciones no comprometen la interacción entre el virus y su receptor (12).
Un estudio realizado por Zhang et al. demuestra que ómicron presenta disminución significativa en la sensibilidad frente a la neutralización por anticuerpos generados por infecciones previas, excediendo los resultados de las VOC que la anteceden, probablemente debido a la capacidad de evasión inmunológica aumentada con respecto a las variantes Beta y Delta (17); por otro lado, existe evidencia que sugiere que las dosis de refuerzo de las vacunas pueden mejorar la protección contra la nueva variante, pero sin datos concretos sobre su efectividad (7), lo cual implica cambios importantes en el enfoque de la salud pública, con el fin de mantener a raya y/o evitar una nueva ola de contagios masivos.
Patogénesis
La patogenia del SARS-Cov-2 inicia desde la unión a la proteína S, la cual permite la fusión de membranas y posterior liberación del ácido ribonucleico monocatenario (ARNmc), lo que conlleva a la liberación de poliproteínas llamadas pp1a y pp1b; estas proteínas son divididas para la formación de proteínas no estructurales, y así iniciar la transcripción y traducción viral (18). Con respecto a ómicron se ha encontrado que esta variante posee características definitorias respecto a las demás.
Fahadul Islam y colaboradores descubrieron que mutaciones en RBD y NTD juegan un papel fundamental en la gravedad e infecciosidad del SARS-Cov-2 (19). Además, que el escape de anticuerpos se debe a las mutaciones V445E y K444 Q/R/N en RBD y K150 T/Q/R/E con N148S en NTD (20). Por otro lado, se ha demostrado que ómicron RBD puede evadir el reconocimiento de un gran número de anticuerpos derivados de MBC (células B de memoria; para esto se comparó la afinidad de unión que presentaban los anticuerpos hacia ómicron Hu-1 RBD ancestral y ómicron RBD y se observó una reducción de la afinidad en este último (21).
El dominio de unión al receptor RBD, que se encuentra en la proteína S presente se une al receptor ACE2 para ingresar a la célula (22). Las mutaciones de la proteína espigan han mostrado tener una amplia compatibilidad con el receptor RBD, además de otorgar resistencia a diferentes anticuerpos neutralizantes producidos por el organismo. Característica evidenciada ante la no respuesta de ómicron al 85 % de los anticuerpos neutralizantes (23).
Se han encontrado algunas variaciones en la proteína S específicas que resultan importantes de mencionar, pues promueven la patogénesis; por ejemplo, la sustitución P681H le da a ómicron más estabilidad de unión con el receptor de ACE (r-ACE) (12). Por otro lado, mutaciones como la K417N presentes en el dominio de unión al receptor fomentan la evasión a anticuerpos y mayor infección (24). El dominio amino termina de la proteína espiga, se convierte en objetivo para los anticuerpos neutralizantes, sin embargo, este se ve dificultado, ya que en la variante ómicron existen mutaciones de este dominio en los bucles N3 (mutación A143-145) (25).
Como sitio molecular de interés en la variante ómicron también encontramos el sitio de escisión asociado a la furina. La proteína S, al unirse a su receptor en el huésped, pasa por una serie de procesos de escisión sobre sí misma. La inserción de ciertos aminoácidos en el enlace de las subunidades de la proteína S genera el llamado sitio de inserción asociado a la furina, que se ha descrito que aumenta la infectividad y el tropismo del virus. Esta reacción es modulada por la glicosilación O mediada por enzimas humanas llamadas N-acetilgalactosamil-transferasa (GALNT). Tanto las mutaciones en el sitio de escisión de la furina, habiendo tres de ellas descritas en la variante ómicron, así como las mutaciones de las GALNT en las células respiratorias tienen influencia en la infectividad del virus (26).
A pesar de esto, múltiples estudios llevados a cabo en Sudáfrica han concluido que tiende a afectar a la población más joven que aquellas afectadas por brotes anteriores , y adicionalmente se ha encontrado que la enfermedad originada por esta variante tiende a ser menos severa que aquella causada por sus predecesoras; aunque no existen hasta el momento datos concluyentes que indiquen si es debido a la disminución de los factores de virulencia intrínsecos del patógeno o por la evolución de los mecanismos de evasión inmunitaria (26).
Un estudio publicado en The Lancet en marzo de 2022 demostró que ómicron presenta una menor tasa de hospitalización y muerte respecto a la variante Delta en pacientes no vacunados, y disminución del riesgo relativo de las mismas variables de Delta respecto a ómicron, en relación con inefectividad de las vacunas y ausencia de la dosis de refuerzo. En el mismo estudio concluyen que ómicron presenta un 59 % menos admisiones hospitalarias, 44% menos de pacientes hospitalizados y 69 % menos muertes respecto a Delta, debido a la disminución en la presentación severa en mayores de 50 años (27-29).
Cao et. al. caracterización junto a su grupo de investigación poco menos de 250 anticuerpos neutralizantes contra el dominio de unión al receptor, y los clasificaron en 6 grupos (A-F). Los primeros 4 (A-D) coinciden con los grupos 1 y 2 de clasificación de anticuerpos y los E y F con los grupos 3 y 4. Concluyeron que mutaciones como K417N, G446S, E484A y Q493R, afectan a los grupos A-D y que mutaciones como G339D, N440K, S371L y S375F disminuyen la efectividad de aquellos anticuerpos en los grupos E y F (23).
Gracias a todas estas mutaciones su detección en las pruebas como rastreo del gen de la proteína espiga se ha vuelto menos efectiva, probablemente por cambios en la proteína en las posiciones 69-70 (30). Para compensar esto se ha optado por buscar genes como E484K/Q, L452R, y N501Y (31).
Vacunas
Con la aparición de la variante ómicron surgió la necesidad de crear rápidamente una vacuna para controlarla. Las vacunas y sus dosis de refuerzo aumentan o mejoran la respuesta inmunitaria, proporcionando una protección adicional (32). Sin embargo, las mutaciones en el RBD de la variante ómicron afectan el patrón de unión a los anticuerpos y, por tanto, afectan la eficacia de las vacunas. También se ha estudiado los cambios en la energía liberada por la unión entre la proteína S y los anticuerpos humanos, y se encontró en esta variante una mayor cantidad de cambios negativos que positivos y, por ende, mayor probabilidad de eludir la unión del anticuerpo a su receptor. Se ha descrito que la mutación K417N es la que más afecta significativamente la unión de los anticuerpos, sin embargo, las E484A y Y505H también son dignas de mencionar (11).
Por otro lado, la respuesta de los anticuerpos y la eficacia de las vacunas disminuye a medida que el tiempo postvacunación aumenta, y es afectada por la aparición de nuevas variantes, como es el caso de la variante ómicron, pues tiene un gran potencial de escapar a la respuesta humoral inducida por las vacunas. Así mismo, se han propuesto estrategias al respecto. García et al. realizaron un estudio para determinar el papel que juega el refuerzo con una vacuna ARN mensajero (ARNm) adicionada al esquema previo, evaluando la eficacia de la unión de anticuerpos al administrar un pseudovirus. Los resultados mostraron que la vacunación primaria era insuficiente para neutralizar al virus. Sin embargo, la adición de la vacuna ARNm generaba una respuesta cruzada que bien podría aumentar la afinidad de anticuerpos preexistentes o afectando nuevas dianas en el virus (33). En el momento, las vacunas ARNm son la mRNA-1273 (Moderna) y la BNT162b2 (Pfi-zer-BioNTech). Esta última ha demostrado tener una eficacia leve contra la variante ómicron, pero ayuda al individuo a evitar complicaciones graves. Un estudio hecho por Discovery Ltd. demostró que ómicron redujo del 80 al 33 % la efectividad de la vacuna para la variante Delta y que personas infectadas con otras variantes tenían más posibilidades de contraer la variante ómicron; por ejemplo, aquellos que tuviesen la variante Beta tenían un riesgo mayor equivalente al 60 % de tener ómicron y los infectados con la variante Delta un 40 % (34).
Hongjie Xia y colaboradores hicieron un estudio para probar la neutralización de los anticuerpos de la vacuna BNT16b2 contra la variante ómicron; para esto se comparó la capacidad que tenían los individuos para neutralizar SARS-CoV-2 de tipo salvaje (USA-WA1/2020) y un USA-WA1/2020 diseñado a partir de la glicoproteína de pico ómicron. Demostraron que los títulos medios geométricos (GMT) de neutralización contra ómicron-espiga después 3 dosis de BNT16b2 estuvo en rangos muy parecidos al GMT de neutralización contra USA-WA1/2020 después de 2 dosis, por lo que se llegó a la conclusión de que 3 dosis ayudan a disminuir el impacto que tenga esta variante en la salud (35). Por otro lado, BioNTech & Pfizer confirmaron que tres dosis de esta vacuna ayudan a tratar la variante ómicron-espiga, aumentando el número de anticuerpos 25 veces; sin embargo también se concluyó que tras la aplicación de dos dosis es posible neutralizar la variante. (36).
La vacuna ChAdOx1 nCoV-19 (AstraZeneca), desarrollada en la Universidad de Oxford, y la cual se basa en un vector de adenovirus no replicante de chimpancé, puede producir inmunogenicidad contra COVID-19 en una sola dosis (37). Se conoce que tiene una baja eficacia en la variante ómicron durante la vacunación primaria, pero una eficacia de hasta el 75 % tras la administración de dosis de refuerzo (31). Por otro lado, diferentes estudios sobre el uso de la vacuna ChAdOx1 mostraron que tiempo después de recibir la vacuna, los pacientes presentaban signos clínicos como trombosis en diferentes sitios, trombocitopenia trombótica autoinmune, dímero D y títulos elevados de IgG contra PF4, que generaban un fenotipo plaquetario pro coagulante, asociado a otros problemas de salud que deberán ser tenidos en cuenta (38,39)
Por último, un estudio hecho por Tianhong Xie y acompañantes demostró que tres dosis de vacuna prototípica del SARS-CoV-2 inactivada KMS-1 (VacKMS1) con anticuerpos neutralizantes podrían brindar protección cruzada contra sus variantes de preocupación (VOC) y que además podrían disminuir la transmisión y replicación de estas solo si está presente el nivel óptimo de anticuerpos neutralizantes (40).
Manejo
En cuanto al tratamiento, dado la creciente investigación en anticuerpos monoclonales y que su sitio de acción se vea sujeto a constantes mutaciones, determinar su rol se ha convertido en un reto para distintos estudios clínicos. Los anticuerpos monoclonales han sido usados para pacientes con enfermedad leve a moderada con títulos de anticuerpos negativos o alto riesgo de complicación como método de prevención de hospitalización y muerte (41). Estos anticuerpos son clasificados en 4 grupos dependiendo del lugar donde hagan su efecto, siendo los primeros dos específicos para competir por el dominio de unión de ACE2 humano. El 3 y 4 interaccionan lejos de este dominio en el mismo ACE2 humano. Las mutaciones de ómicron afectan a los cuatro grupos de anticuerpos, haciéndolos a todos menos efectivos (31).
De los anticuerpos monoclonales aprobados por la FDA, se ha encontrado los producidos por Eli Lilly: LY-CoV555 (bamlamivimab) y LY-CoV016 (etesevimab) son poco efectivos ante la variante BA.1 y BA.2, individualmente o en combinación, mientras que los producidos por Regeneron: REGN10987 (imdevimab) y su combinación con REGN10933 (casirivimab) tienen más actividad para la BA.2 que para la BA.1, y han demostrado menor efectividad in vitro contra ómicron (42). Sin embargo, el FRNT50 (Títulos de anticuerpos requeridos para inhibir el 50 % del foco infeccioso) es mucho mayor en la variante BA.2 que en otras VOC (43). En contraste, la Vir-7831 (producido por GlaxoSmithKline) y la mezcla producida por AztraZeneca: AZD8895 y AZD1061 (cilgavimab - tixagevimab), tienen mejor actividad neutralizante contra dichas variantes, pero en menor proporción respecto a las variantes Delta y D614G (44). El Sotrovimab ya había tenido un rol en variantes anteriores, sin embargo, a pesar de tener actividad considerable en la variante BA.1, no tiene actividad frente a la BA.2 (45). Por último, respecto al LY-CoV1404 (Bebtelovimab), su unión al RBD no parece ser afectada por las mutaciones de la variante BA.2, por lo que es potencialmente efectivo frente a los sublinajes de ómicron (46). Si bien los anticuerpos monoclonales han demostrado ser efectivos en la reducción de la carga viral, y la evidencia sugiere la prevención de desarrollo de complicaciones, hasta el momento no han demostrado beneficio en pacientes hospitalizados y la evidencia es escasa respecto a desenlaces clínicos en enfermedad grave por las nuevas variantes. Así mismo, su difícil acceso, el requerimiento de aplicación intravenosa y la necesidad de aplicarla poco tiempo después del inicio de los síntomas limitan aún más su uso.
En cuanto a las terapias antivirales orales, se pueden encontrar dos tipos de fármacos: el primero corresponde a un análogo ribonucleótido que inhibe la replicación del SARS-Cov-2, y el segundo es un inhibidor que actúa sobre la proteasa y el ARN polimerasa. Sin embargo, la evidencia es insuficiencia sobre su efecto en la variante ómicron (47).
Finalmente, la Organización Mundial de la Salud, debido a la poca efectividad que han tenido tratamientos como los mencionados, ha reportado la posibilidad del uso de bloqueadores de los receptores IL-6 y corticosteroides como tratamiento en aquellos pacientes que cursan con estadio grave del COVID-19 y con diagnóstico previo de infección por la variante ómicron (48). En medio de esta situación se sigue sugiriendo la aplicación de medidas sanitarias para reducir el riesgo de infección por COVID-19 con las variantes emergentes, mientras se evalúan nuevas opciones terapéuticas (49).
CONCLUSIONES
Se puede concluir que la variante ómicron ha demostrado una mayor transmisibilidad con respecto a variantes ya descritas asociadas al SARS-CoV-2. El tratamiento disponible en la actualidad ha demostrado tener impacto en severidad y curso de la enfermedad. Finalmente, la vacunación, como medida más efectiva hasta el momento, requiere de estudios adicionales para generar un mayor impacto sobre la variante ómicron.
REFERENCIAS
1. Raman R, Patel KJ, Ranjan K. Covid-19: Unmasking emerging sars-cov-2 variants, vaccines and therapeutic strategies. Biomolecules. 2021;11(7).
2. Centers of Disease Control and Prevention. SARS-CoV-2 Variant Classifications and Definitions [Internet]. CDC. 2021[citado 21 abr 2022]. Disponible en: https://www.cdc.gov/coronavirus/2019-ncov/variants/variant-classifications.html.
3. OMS. Seguimiento de las variantes del SARS-CoV-2 [Internet]. [citado 21 abr 2022]. Disponible en: https://www.who.int/es/activities/tracking-SARS-CoV-2-variants.
4. Thakur V, Ratho RK. OMICRON (B.1.1.529): A new SARS-CoV-2 variant of concern mounting worldwide fear. Journal of Medical Virology. 2022;94(5):1821-4.
5. He X, Hong W, Pan X, Lu G, Wei X. SARS-CoV-2 Omicron variant: Characteristics and prevention. Me-dComm (Beijing). 2021;2(4):838-45.
6. Karim SSA, Karim QA. Omicron SARS-CoV-2 variant: a new chapter in the COVID-19 pandemic. Vol. 398, The Lancet. Elsevier B.V.; 2021. p. 2126-8.
7. Madhi SA, Ihekweazu C, Rees H, Pollard AJ. Decoupling of omicron variant infections and severe COVID-19. Vol. 399, The Lancet. Elsevier B.V.; 2022. p. 1047-8.
8. Nile SH, Nile A, Qiu J, Li L, Jia X, Kai G. COVID-19: Pathogenesis, cytokine storm and therapeutic potential of interferons. Vol. 53, Cytokine and Growth Factor Reviews. Elsevier Ltd; 2020. p. 66-70.
9. Walls AC, Tortorici MA, Snijder J, Xiong X, Bosch BJ, Rey FA et al. Tectonic conformational changes of a coronavirus spike glycoprotein promote membrane fusion. Proc Natl Acad Sci USA. 2017 oct 17;114(42):11157-62.
10. Papanikolaou V, Chrysovergis A, Ragos V, Tsiambas E, Katsinis S, Manoli A et al. From delta to Omicron: S1-RBD/S2 mutation/deletion equilibrium in SARS-CoV-2 defined variants. Gene [Internet]. 2022 mar;814(enero):146134. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S0378111921007290
11. Chen J, Wang R, Gilby NB, Wei GW. Omicron (B.1.1.529): Infectivity, vaccine breakthrough, and antibody resistance. 2021 dic 1. Disponible en: http://arxiv.org/abs/2112.01318.
12. Hoffmann M, Krüger N, Schulz S, Cossmann A, Rocha C, Kempf A, et al. The Omicron variant is highly resistant against antibody-mediated neutralization: Implications for control of the COVID-19 pandemic. Cell. 2022 feb 3;185(3):447-456.e11.
13. William A. Haseltine. Understanding Omicron: Changes In The Spike Protein And Beyond And What They Portend. 2021;1-10. Disponible en: https://www.forbes.com/sites/williamhaseltine/2021/12/08/omicron-the-sum-of-all-fears/?sh=31923e3f5b51
14. Kannan S, Shaik Syed Ali P, Sheeza A. Omicron (B.1.1.529) - variant of concern - molecular profile and epidemiology: a mini review. European Review for Medical and Pharmacological Sciences. 2021;25:8019-22.
15. Fonager J, Bennedbæk M, Bager P, Wohlfahrt J, Ellegaard KM, Ingham AC et al. Molecular epidemiology of the SARS-CoV-2 variant Omicron BA.2 sub-lineage in Denmark, 29 November 2021 to 2 January 2022. Euro surveillance: European communicable disease bulletin = European communicable disease bulletin. 2022 mar 10;27(10).
16. Zheng J, Wang Z, Li J, Zhang Y, Jiang L, Fu Y et al. High amounts of SARS-CoV-2 in aerosols exhaled by patients with Omicron variant infection. Journal of Infection. 2022 .
17. Wang Y, Zhang L, Li Q, Liang Z, Li T, Liu S et al. The significant immune escape of pseudotyped SARS-CoV-2 variant Omicron. Emerging Microbes and Infections. 2022;11(1):1-5.
18. Asrani P, Hasan GM, Sohal SS, Hassan MI. Molecular Basis of Pathogenesis of Coronaviruses: A Comparative Genomics Approach to Planetary Health to Prevent Zoonotic Outbreaks in the 21st Century. OMICS A Journal of Integrative Biology. 2020 nov 1;24(11):634-44.
19. Islam F, Dhawan M, Nafady MH, Emran T bin, Mitra S, Choudhary OP et al. Understanding the omicron variant (B.1.1.529) of SARS-CoV-2: Mutational impacts, concerns, and the possible solutions. Annals of Medicine and Surgery [Internet]. 2022 mayo;103737. Disponible en: https://doi.org/10.1016/jbiteb.2019.100310.
20. Bhattacharya M, Sharma AR, Dhama K, Agoramoorthy G, Chakraborty C. Omicron variant (B.1.1.529) of SARS-CoV-2: understanding mutations in the genome, S-glycoprotein, and antibody-binding regions. Geroscience [Internet]. 2022;(0123456789). Disponible en: https://doi.org/10.1007/s11357022-00532-4.
21. Sokal A, Broketa M, Barba-Spaeth G, Meola A, Fernández I, Fourati S et al. Analysis of mRNA vaccination-elicited RBD-specific memory B cells reveals strong but incomplete immune escape of the SARS-CoV-2 Omicron variant. Immunity [Internet]. 2022 abr;1-9. Disponible en: https://linkinghubelsevier.com/retrieve/pii/S107476132200173X.
22. Goutam Mukherjee A, Ramesh Wanjari U, Murali R, Chaudhary U, Renu K, Madhyastha H et al. Omicron variant infection and the associated immunological scenario. Immunobiology [Internet]. 2022 mayo;152222. Disponible en: https://doi.org/10.1016/j.imbio.2022.152222.
23. Cao Y, Wang J, Jian F, Xiao T, Song W, Yisimayi A et al. Omicron escapes the majority of existing SARS-CoV-2 neutralizing antibodies. Nature 2021 602:7898 [Internet]. 2021 dic 23 [citado 14 abr 2022];602(7898):657-63. Disponible en: https://www.nature.com/articles/s41586-021-04385-3.
24. Li Q, Nie J, Wu J, Zhang L, Ding R, Wang H et al. SARS-CoV-2 501Y.V2 variants lack higher infectivity but do have immune escape. Cell [Internet]. 2021 abr 29 [citado23 abr 2022];184(9):2362-2371.e9. Disponible en: https://doi.org/10.1016/j.cell.2021.02.042.
25. Cerutti G, Guo Y, Zhou T, Gorman J, Lee M, Rapp M et al. Potent SARS-CoV-2 neutralizing antibodies directed against spike N-terminal domain target a single supersite. Cell Host and Microbe [Internet]. 2021 mayo 12 [citado 23 abr 2022];29(5):819-833.e7. Disponible en: https://doi.org/10.1016/jchom.2021.03.005.
26. Zhang L, Mann M, Syed ZA, Reynolds HM, Tian E, Samara N et al. Furin cleavage of the SARS-CoV-2 spike is modulated by O-glycosylation. Proc Natl Acad Sci USA [Internet]. 2021;118(47). Disponible en: http://www.pnas.org/lookup/.
27. Nyberg T, Ferguson NM, Nash SG, Webster HH, Flaxman S, Andrews N et al. Comparative analysis of the risks of hospitalisation and death associated with SARS-CoV-2 omicron (B.1.1.529) and delta (B.1.617.2) variants in England: a cohort study. The Lancet. 2022 abr;399(10332):1303-12.
28. Shuai H, Chan JFW, Hu B, Chai Y, Yuen TTT, Yin F et al. Attenuated replication and pathogenicity of SARS-CoV-2 B.1.1.529 Omicron. Nature. 2022 mar 24;603(7902):693-9.
29. for Disease Control C. Morbidity and Mortality Weekly Report SARS-CoV-2 B.1.1.529 (Omicron) Variant-United States [Internet]. Disponible en: https://www.ncbi.nlm.nih.gov/sars-cov-2.
30. Dhawan M, Priyanka, Choudhary OP. Omicron SARS-CoV-2 variant: Reasons of emergence and lessons learnt. International Journal of Surgery [Internet]. 2022 ene 1 [citado 3 may 2022];97. Disponible en: https://doi.org/10.1016/j.ijsu.2021.106198.
31. Joshi G, Poduri R. Omicron, a new SARS-CoV-2 variant: assessing the impact on severity and vaccines efficacy. Human Vaccines & Immunotherapeutics [Internet]. 2022;00(00):1-2. Disponible en: https://doi.org/10.1080/21645515.2022.2034458
32. Callaway E. COVID vaccine boosters: the most important questions. Nature [Internet]. 2021 ago 12;596(7871):178-80. Disponible en: https://www.nature.com/articles/d41586-021-02158-6.
33. Garcia-Beltran WF, st. Denis KJ, Hoelzemer A, Lam EC, Nitido AD, Sheehan ML et al. mRNA-based COVID-19 vaccine boosters induce neutralizing immunity against SARS-CoV-2 Omicron variant. Cell. 2022 feb 3;185(3):457-466.e4.
34. MINLU Z. Omicron now accounts for 3% of US coronavirus cases. China Daily Global [Internet]. 2021. Disponible en: https://global.chinadaily.com.cn/a/202112/15/WS61b95f63a310cdd39bc7b7f8.html.
35. Xia H, Zou J, Chaitanya Kurhade XX, Swanson KA, Shi PY. Neutralization and durability of 2 or 3 doses of the BNT162b2 vaccine against Omicron SARS-CoV-2. Cell Host & Microbe [Internet]. 2022. Disponible en: https://www-sciencedirect-com.ez.unisabana.edu.co/science/article/pii/S1931312822001019#fig1.
36. MINLU Z. Pfizer: Booster protects against Omicron. China Daily Global [Internet]. 2021. Disponible en: https://www.chinadaily.com.cn/a/202112/09/WS61b1141aa310cdd39bc7a2d8.html.
37. Banerjee S, Banerjee D, Singh A, Saharan VA. A Comprehensive Investigation Regarding the Differentiation of the Procurable COVID-19 Vaccines. AAPS PharmSciTech [Internet]. 2022;23(4). Disponible en: https://doi.org/10.1208/s12249-022-02247-3.
38. Schultz NH, S0rvoll IH, Michelsen AE, Munthe LA, Lund-Johansen F, Ahlen MT et al. Thrombosis and Thrombocytopenia after ChAdOx1 nCoV-19 Vaccination. New England Journal of Medicine.2021;384(22): 2124-30.
39. Althaus K, Möller P, Uzun G, Singh A, Beck A, Bettag M et al. Antibody-mediated procoagulant platelets in SARS-CoV-2- vaccination associated immune thrombotic thrombocytopenia. Haematologica [Internet]. 2021 may 20;106(8):2170-9. Disponible en: https://haematologica.org/article/view/haematol.2021.279000
40. Xie T, Lu S, He Z, Liu H, Wang J, Tang C et al. Three doses of prototypic SARS-CoV-2 inactivated vaccine induce cross-protection against its variants of concern. Signal Transduction and Targeted Therapy [Internet]. 2022 Dec 25;7(1):61. Disponible en: https://www.nature.com/articles/s41392-022-00920-4.
41. Tratamientos y medicamentos para el COVID-19 _ CDC.
42. National Institutes of Health. Treatment Guidelines Panel. Coronavirus Disease 2019 (COVID-19). Nih [Internet]. 2021;2019:1-243. Disponible en: https://www.covid19treatmentguidelines.nih.gov/.%0A https://www.covid19treatmentguidelines.nih.gov/.
43. Takashita E, Kinoshita N, Yamayoshi S, Sakai-Tagawa Y, Fujisaki S, Ito M et al. Efficacy of Antiviral Agents against the SARS-CoV-2 Omicron Subvariant BA.2. NEngl JMed [Internet]. 2022 abr 14 [citado 16 abr 2022 ];386(15):1475-7. Disponible en: https://pubmed.ncbi.nlm.nih.gov/35263535/.
44. Zhou H, Tada T, Dcosta BM, Landau NR. Neutralization of SARS-CoV-2 Omicron BA.2 by Therapeutic Monoclonal Antibodies. bioRxiv [Internet]. 2022 feb 24 [citado 16 abr 2022]. Disponible en: /pmc/articles/PMC8863139/.
45. Fact sheet for healthcare providers emergency use authorization (EUA) of sotrovimab authorized use. 2022 [citado 16 abr 2022]. Disponible en: https://www.fda.gov/emergency-preparedness-and-response/mcm-legal-.
46. Westendorf K, Wang L, Zentelis S, Foster D, Vaillancourt P, Wiggin M et al. LY-CoV1404 (bebtelovi-mab) potently neutralizes SARS-CoV-2 variants. bioRxiv [Internet]. 2022 ene 7 [citado 16 abr 2022]. Disponible en: https://pubmed.ncbi.nlm.nih.gov/33972947/.
47. Ferré VM, Peiffer-Smadja N, Visseaux B, Descamps D, Ghosn J, Charpentier C. Omicron SARS-CoV-2 variant: What we know and what we don't. Vol. 41, Anaesthesia Critical Care and Pain Medicine. Elsevier Masson s.r.l.; 2022.
48. Mohiuddin M, Kasahara K. Investigating the aggressiveness of the COVID-19 Omicron variant and suggestions for possible treatment options. Vol. 191, Respiratory Medicine. W.B. Saunders Ltd; 2022.
49. Mohapatra K, Kuppili S, Kumar T, Kandi V, Behera A, Verma S et al. SARS- CoV- 2anditsvariantsofcon-cernincludingOmicron: Aneverendingpandemic. Chem Biol Drug Des. 2022;99.