Fecha de recepción: junio 14 de 2022 Fecha de aceptación: marzo 6 de 2023
ARTíCULO REVISIóN SISTEMATICA https://dx.doi.org/10.14482/sun.39.03.005.258
Uso de N-acetilcisteína en pacientes que desarrollaron hepatitis por medicamentos antituberculosos: revisión sistemática
Use of N-acetylcysteine in patients with hepatitis by antitubercular agents: systematic review
José Julián Aristizábal-Hernández1, Ana María Bravo-Andrade2, Alejandro Henao-Villada3, Andrea Mazo-Cañola4, Jorge Hernando Donado-Gómez5
1 Médico toxicólogo clínico graduado de la Universidad de Antioquia, docente de la Universidad Pontificia Bolivariana - Escuela de Ciencias de la Salud, Facultad de Medicina y Toxicólogo de la Clínica Universitaria Bolivariana. Orcid: https://orcid.org/0000-0002-3754-1172. CvLAC: https://scienti.minciencias.gov.co/cvlac/visualizador/generarCurriculoCv.do?cod_rh=0000004982. josej.aristizabal@upb.edu.co
2 Médica graduada de la Universidad Pontificia Bolivariana. Orcid: https://orcid.org/0000-0002-3313-2363. CvLAC: https://scienti.minciencias.gov.co/cvlac/visualizador/generarCurriculoCv.do?cod_rh=0002021766. anabravo3@hotmail.com
3 Médico graduado de la Universidad Pontificia Bolivariana. Orcid: https://orcid.org/0000-0001-9809-7055. CvLAC: https://scienti.minciencias.gov.co/cvlac/visualizador/generarCurriculoCv.do?cod_rh=0002022008. alejandro99henao@gmail.com
4 Médica graduada de la Universidad Pontificia Bolivariana. Orcid: https://orcid.org/0000-0001-5282-6208. CvLAC: https://scienti.minciencias.gov.co/cvlac/visualizador/generarCurriculoCv.do?cod_rh=0002021659. Andreamazo982@gmail.com.
5 Médico internista graduado de la Universidad Pontificia Bolivariana, docente de la Universidad Pontificia Bolivariana - Escuela de Ciencias de la Salud, Facultad de Medicina. Internista del Hospital Pablo Tobón Uribe. Orcid: https://orcid. org/0000-0001-8581-2267. CvLAC: https://scienti.minciencias.gov.co/cvlac/visualizador/generarCurriculoCv.do?cod_rh=0000173223. jorge.donado@upb.edu.co
RESUMEN
El objetivo de esta revisión sistemática fue estimar la efectividad de la N-acetilcisteína en el tratamiento de hepatotoxicidad por antituberculosos; se incluyeron ensayos clínicos controlados aleatorizados, sin restricciones de idioma ni estado de publicación; se tuvieron en cuenta estudios publicados hasta diciembre de 2022. Búsqueda en bases de datos bibliográficas: CENTRAL, CINAHL, LILACS, MEDLINE, Pubmed, Scielo, Scopus y Web of Science; de 33 artículos encontrados, uno cumplió los criterios de inclusión con bajo riesgo de sesgos. El tiempo a mejoría bioquímica del grupo intervención fue 7,5 días (RIQ 5,5-11) y en el grupo placebo 8 (RIQ 5-13). El tiempo de estancia hospitalaria en el grupo intervención fue 9 días (RIQ 6-15) y en el grupo placebo 18 (RIQ 10-25). La mortalidad no difirió entre grupos y fue 14 %. No es posible concluir sobre el efecto terapéutico de la N-acetilcisteína en pacientes con DILI por antituberculosos, lo cual justifica realizar ensayos clínicos.
Palabras clave: acetilcisteína, hepatitis, agentes antituberculosos.
ABSTRACT
The aim of this systematic review was to estimate the effectiveness of N-Acetylcysteine in the treatment of hepatotoxicity induced by antitubercular agents, we included randomized clinical trials, there was no language nor publication status restriction, published until December 2021. The searched databases were CENTRAL, CINAHL, LILACS, MEDLINE, Pubmed, Scielo, Scopus y Web of Science; out of 33 articles found, one of them met the inclusion criteria and had low bias risk. The time to biochemical resolution was 7,5 days (IQR 5,511) in the treatment arm, and 8 (IQR 5-13) in the placebo arm. Time of hospital stay was 9 days (IQR 6-15) in the treatment arm, and 18 (IQR 10-25) in the placebo arm. Mortality (14 %) didn't differ between groups. Further clinical trials may be needed to determine the therapeutic role of N-acetylcysteine in patients with drug-induced liver injury caused by antituberculous agents.
Keywords: acetylcysteine, hepatitis, antitubercular agents.
INTRODUCCIóN
La lesión hepática inducida por medicamentos, conocida por sus siglas en inglés como DILI (Drug-Induced Liver Injury), es el término designado a cualquier tipo de daño hepático secundario a la administración de medicamentos(1), y es la principal causa de falla hepática en el hemisferio occidental (2). Es difícil estimar la verdadera incidencia de DILI en Colombia debido a la falta de estadísticas actualizadas de esta entidad; se tiene un registro de 44 casos colombianos entre 1996 y 2012, reportados por la Red Hispano Latinoamericana de Hepatotoxicidad(3).
El medicamento más frecuentemente implicado en DILI es el acetaminofén, pero otros medicamentos también pueden asociarse a este fenómeno, como por ejemplo, amoxicilina/clavulánico, los antituberculosos y el diclofenaco (2,4). En cuanto a los antituberculosos, los de primera línea son los que más se han asociado a hepatotoxicidad, y en su orden son pirazinamida, isoniazida y rifampicina(5). La frecuencia reportada de DILI causada por isoniazida y rifampicina es del 0,6 y 1,1%, respectivamente(6).
Aun así, la mayoría de los casos por DILI se explican por características del individuo y no por propiedades de los medicamentos (7). Existen algunos factores de riesgo descritos, entre los cuales están la edad avanzada, el sexo femenino, el alcoholismo, el tabaquismo, la desnutrición, la infección por virus hepatotropos y la hipoalbuminemia (1,5,7).
El tratamiento estándar ante la lesión hepática inducida por medicamentos suele basarse en suspender los agentes causantes y hacer seguimiento bioquímico (1,8). En el caso del acetaminofén, el tratamiento de elección es la N-acetilcisteína (NAC), medicamento con actividad antioxidante directa e indirecta y con efectos antiinflamatorios importantes. Este agente reduce el daño por estrés oxidativo a nivel celular, mitocondrial y de membrana, regula la apoptosis e inhibe la liberación de citoquinas (2,8).
Está descrito que la NAC es de utilidad en DILI no causada por acetaminofén tanto para prevención como para tratamiento (9), sin embargo, pocas veces ha sido valorada específicamente en el caso de antituberculosos y las principales guías clínicas no lo recomiendan. Por tal motivo, se planteó realizar una revisión sistemática de ensayos clínicos que evalúen el uso de este medicamento en pacientes adultos en tratamiento con antituberculosos que presenten DILI, en comparación con el tratamiento estándar o placebo.
METODOLOGíA
Protocolo y registro
El protocolo de esta revisión sistemática no fue inscrito en el Registro Internacional de Revisiones sistemáticas (International prospective register of systematic reviews: PROSPERO), sin embargo, está incluido en el material suplementario. Esta revisión se realizó siguiendo las recomendaciones de la Colaboración Cochrane(10) y la publicación en concordancia con la lista de chequeo del PRISMA 2020 (Referred Reporting Items for Systematic Reviews and Meta-Analyses) (11).
Criterios de elegibilidad
Se incluyeron ensayos clínicos controlados aleatorizados en los que se estudiaran pacientes adultos con DILI por antituberculosos, que hubieran evaluado el uso terapéutico de NAC, por cualquier vía de administración, comparado con el no uso de esta, y en los que se hayan evaluado los siguientes desenlaces: tiempo a la mejoría bioquímica de la hepatitis, estancia hospitalaria y mortalidad. No hubo restricciones de idioma ni por el estado de publicación. Se tuvieron en cuenta estudios publicados hasta diciembre de 2022. Se excluyeron artículos en los que se evaluara el uso de NAC como profilaxis para DILI por antituberculosos.
Estrategia de búsqueda
Entre diciembre de 2021 y diciembre de 2022 se realizó una búsqueda sistemática por parte de tres autores (AMB, AMC, AHV) con algoritmos de búsqueda (ver tabla 1) construidos en inglés, idioma utilizado para esta. Dichos algoritmos se utilizaron en las bases de datos PubMed (MEDLINE), LILACS, CINAHL, EMBASE, Registro CENTRAL de ensayos clínicos de Cochrane, Scopus, Scielo y Web of Science. Adicionalmente, se hizo una búsqueda en fuentes diferentes a bases de datos bibliográficas electrónicas, como contacto con investigadores, registros de ensayos clínicos en Clinicaltrials.gov, ISRCTN.com (International Standardised Randomised Controlled Trial Number), Clinicaltrialsregister.eu, ICTRP (International Clinical Trials Registry Platform), revisión en las agencias regulatorias como FDA (Food & Drug Administration) y EMA (European Medicines Agency) y se revisaron las referencias bibliográficas de artículos de revisión(12).

Selección de estudios
Tres autores (AMB, AMC, AHV) examinaron de manera independiente títulos y resúmenes que resultaron de la búsqueda en bases de datos, los cuales fueron evaluados según los criterios de inclusión. Se obtuvieron los reportes completos de los títulos que cumplieron los criterios de inclusión o en los que hubo incertidumbre. Los autores luego leyeron el texto completo y definieron si cumplían con los criterios establecidos. Se registraron las razones de exclusión de los estudios. Ninguno de los autores fue cegado frente a los títulos, autores o instituciones de los ensayos.
Recolección de la información
Se creó un formulario en Google Forms, en el cual tres autores (AMB, AMC, AHV) de manera independiente realizaron la extracción de la siguiente información: características sociodemográficas (edad, sexo), características clínicas (tiempo de estancia hospitalaria, mortalidad, infección por virus hepatotrópos, infección por VIH), características de laboratorio (albúmina en sangre, ALT, bilirrubinas, fosfatasa alcalina) y tipo de antituberculoso. Los resultados del formulario fueron puestos en común por parte de los tres autores, y si había discordancia, se llegaba a un consenso entre los mismos. Los resultados finales fueron diligenciados en una tabla en Microsoft Word.
Evaluación de riesgo de sesgos
Para evaluar el riesgo de sesgos de los artículos cada investigador (AMB, AMC, AHV) evaluó individualmente los dominios de generación y cegamiento de la secuencia de aleatorización, cegamiento de las intervenciones, pérdidas en el seguimiento, y el reporte selectivo de desenlaces, por medio de la herramienta RoB 2.0 de Cochrane (13); en caso de haber algún desacuerdo, se resolvieron mediante un consenso entre los tres investigadores. El riesgo de sesgos se consideró bajo solo si todos los dominios fueron calificados como "bajo riesgo de sesgos".
Desenlaces
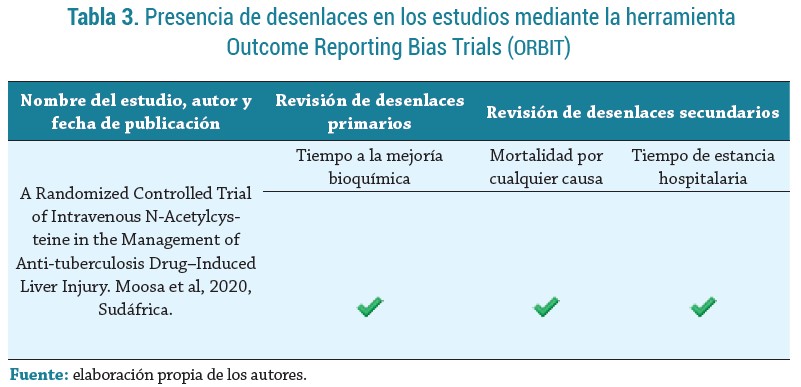
El desenlace primario fue tiempo a la mejoría bioquímica de la hepatitis; los desenlaces secundarios fueron tiempo de estancia hospitalaria y mortalidad por cualquier causa. Tres investigadores (AMB, AMC, AHV) evaluaron de manera independiente la presencia de los desenlaces en los estudios mediante la herramienta Outcome Reporting Bias Trials (ORBIT) (14); en caso de haber algún desacuerdo, se resolvió mediante un consenso por parte de los tres investigadores.
Síntesis de la información
Debido a que solo se encontró un estudio primario, se realizó el resumen descriptivo del mismo. Por lo tanto, el sesgo de publicación del estudio no aplica en esta revisión y, en consecuencia, no se realizó.
RESULTADOS
Selección de los estudios
La figura 1 muestra los resultados de la búsqueda y las razones de exclusión de los estudios. De 35 artículos encontrados, se excluyeron seis debido a que no eran ensayos clínicos (15-20), cinco en los que no se evaluaba la N-acetilcisteína como tratamiento para el DILI (5,15,21-23), dos en los que no se evaluaba el uso de N-acetilcisteína (24,25), y 21 resultados que correspondían a duplicados de otros artículos previamente revisados. La búsqueda a partir de fuentes diferentes a bases de datos bibliográficas electrónicas no arrojó ningún resultado. Solo uno cumplió con los criterios de inclusión (26). Las características del estudio incluido se muestran en la tabla 2.
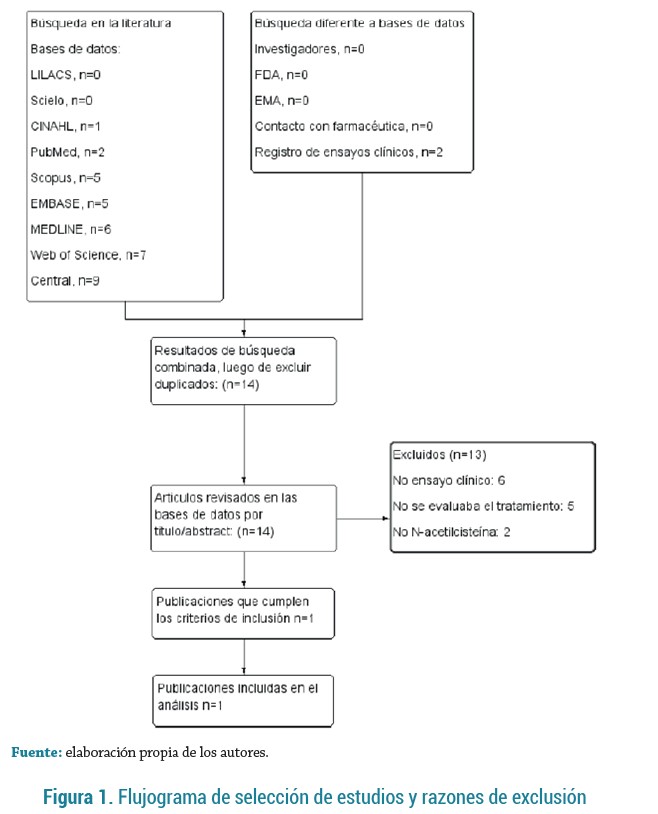
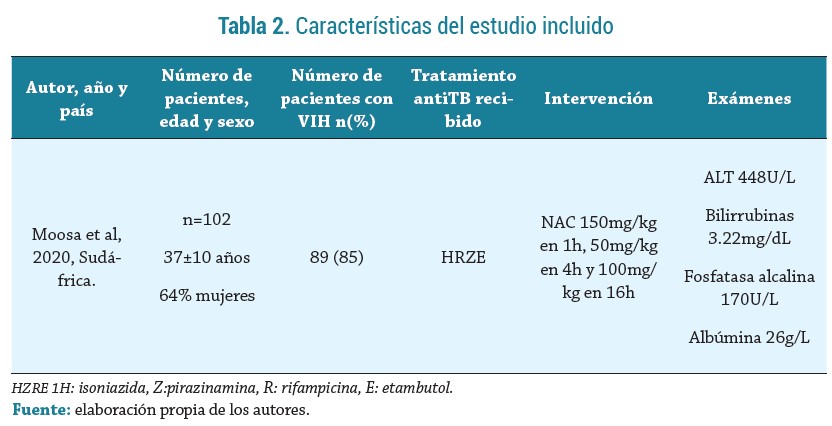
Características del estudio
El estudio seleccionado (Moosa et al.) fue un ensayo clínico controlado, aleatorizado, doble ciego, desarrollado en el contexto de la atención en tres hospitales públicos(New Somerset Hospital, Groote Schuur Hospital y Khayelitsha Hospital) de Ciudad del Cabo (Sudáfrica). Los participantes del estudio fueron aleatorizados en razón de 1:1 para recibir NAC intravenosa o placebo. Los desenlaces evaluados se muestran en la tabla 3.
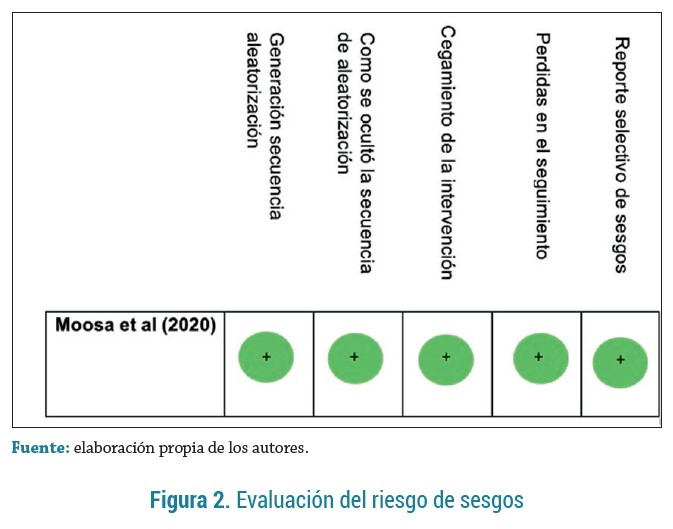
Riesgo de sesgos en el estudio
El estudio se calificó como "bajo riesgo de sesgos" en todos los dominios de la herramienta RoB 2.0(13) (figura 2).
Resultados de estudios individuales
Todos los desenlaces estudiados en la revisión se evaluaron en el estudio incluido que reportó información de 102 pacientes. El tiempo a la mejoría bioquímica del grupo de la intervención tuvo una mediana de 7,5 días (RIQ 5,5-11) y en el grupo placebo tuvo una mediana de 8 días (RIQ 5-13), el HR fue de 1,03 (IC 95% 0,68-1,57).
El tiempo de estancia hospitalaria en el grupo de la intervención tuvo una mediana de 9 días (RIQ 6-15) y en el grupo placebo fue de 18 días (RIQ 10-25), con un HR de 1,73 (IC 95 % 1,13-2,65).
La mortalidad por cualquier causa no difirió entre los grupos y fue de 14%. No se reportó ninguna otra medida de resumen.
Los efectos adversos presentados fueron: náuseas (17 %), vómito, rash, prurito, dolor en el sitio de venoclisis y reacción anafilactoide, con un 2 % cada una.
DISCUSIóN
La NAC es un compuesto que incrementa las concentraciones intracelulares de cisteína a través de mecanismos directos e indirectos, ya sea como profármaco que libera la cisteína por la acción de la enzima acilasa I, o a través de la modulación de los niveles de cisteína unida a proteínas plasmáticas y tisulares a través del intercambio de tiol. Se considera que NAC aumenta los niveles intracelulares de glutatión, que es un depurador no enzimático endógeno de radicales libres, al proporcionar el sustrato cisteína para su síntesis (27).
El desarrollo de DILI por antituberculosos está mediado por diferentes mecanismos, tanto dosis-dependientes como de hipersensibilidad o idiosincráticos. El mecanismo de hepatotoxicidad por pirazinamida no está dilucidado completamente; se ha considerado el efecto tóxico de su metabolito, el ácido 5 hidroxipirazinoico (28-30). La isoniazida es inicialmente metabolizada por la N-acetiltransferasa 2, que resulta en la formación de metabolitos no tóxicos (diacetilhidrazina) y tóxicos (hidrazina); este último, además de tener un efecto tóxico directo, participa en el desarrollo de estrés oxidativo, que también contribuye a la hepatotoxicidad (31). La rifampicina por sí sola tiene bajo potencial de hepatotoxicidad y su metabolismo no produce metabolitos tóxicos (32), sin embargo, puede tener un efecto sinérgico al ser administrada junto con isoniazida, debido a que puede activar ciertos procesos que desencadenan el aumento de metabolitos tóxicos de la isoniazida (31).
Resumen de los resultados
Esta revisión incluyó un artículo que evaluaba la eficacia de NAC en 102 adultos hospitalizados con DILI secundario al tratamiento con antituberculosos. La NAC, comparado con placebo, disminuyó el tiempo de estancia hospitalaria. No hubo diferencias significativas en el tiempo a la mejoría bioquímica ni en la mortalidad entre los grupos de intervención.
En general, se encontró que la N-acetilcisteína fue bien tolerada por los pacientes que la recibieron. Se consideró que los efectos adversos serios presentados durante el estudio no fueron relacionados a la administración del medicamento.
Calidad de la evidencia y aplicabilidad
En el único estudio encontrado, el riesgo de sesgos fue bajo de acuerdo con la herramienta Rob 2.0, sin embargo, debido al tamaño de la muestra, su estimado es impreciso.
No es posible evaluar la aplicabilidad de la intervención a partir de los resultados de nuestra revisión, sin embargo, se podría inferir que la NAC con sus propiedades antioxidantes y antiinflamatorias serviría para el tratamiento de DILI por agentes diferentes al acetaminofén, ya que su patogénesis incluye la formación de metabolitos reactivos, estrés oxidativo e inducción de vías de señalización proinflamatorias (1,33).
Además, se pueden extrapolar resultados de estudios de DILI no inducido por acetaminofén tratado con NAC. Se reporta que el uso terapéutico del medicamento en DILI causado por otros agentes con mecanismos de toxicidad similares a los del acetaminofén genera mejorías en la mortalidad y la condición clínica de los pacientes (34,35).
Adicionalmente, existen reportes de casos en que se usa la NAC en el tratamiento de DILI inducido por medicamentos con mecanismos de toxicidad diferentes a los del acetaminofén, entre estos la amiodarona y el norfloxacino, que han demostrado mejoría bioquímica y del cuadro clínico (33,36-38).
En un estudio prospectivo que evaluaba el rol de la NAC en pacientes adultos con DILI no inducida por acetaminofén, se incluyeron 3 pacientes en el grupo de intervención y 8 en el grupo de control cuya DILI era inducida por antituberculosos, y a pesar de que no se tienen los resultados específicos de estos pacientes, en general se encontró menor mortalidad y estancia hospitalaria con el uso terapéutico de NAC (34).
Otros estudios han estimado el efecto profiláctico de NAC en DILI inducido por antituberculosos tanto en humanos (5,39) como en modelos animales (40,41). Entre estos, un ensayo clínico abierto en el que se incluyeron 60 pacientes (5) y un ensayo clínico doble ciego en el que se incluyeron 88 pacientes (39), ambos encontraron una menor tasa de DILI, disminución en el tiempo de tratamiento y menores valores de transaminasas en el grupo intervención.
A partir de lo expuesto anteriormente se podría especular sobre la eficacia del uso terapéutico de este medicamento en cuadros de DILI inducido por antituberculosos.
Limitaciones
El hecho de que la búsqueda arrojara únicamente un artículo limita la revisión de la literatura por falta de evidencia sobre el asunto y, por ende, impide la elaboración de un metaanálisis.
Investigaciones futuras
Es pertinente desarrollar más ensayos clínicos controlados aleatorizados con suficiente tamaño de muestra para demostrar el beneficio de la NAC en pacientes con DILI inducido por antituberculosos.
CONCLUSIONES
No es posible concluir con confianza sobre el efecto terapéutico de la N-acetilcisteína en pacientes con DILI por antituberculosos, debido a que en esta revisión solo se analizó un estudio al respecto. Es pertinente incentivar el desarrollo de más ensayos clínicos que evalúen el beneficio de esta.
REFERENCIAS
1. Andrade RJ, Chalasani N, Björnsson ES, Suzuki A, Kullak-Ublick GA, Watkins PB et al. Drug-induced liver injury. Nat Rev Dis Primers. 2019 ago 22;5.
2. Katarey D, Verma S. Drug-induced liver injury. Clin Med (Lond) [Internet]. 2016 dic [citado 9 feb 2022];16(Suppl 6):s104-9. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/pmc6329561/.
3. Hernández N, Bessone F, Sánchez A, Pace M di, Brahm J, Zapata R et al. Profile of idiosyncratic drug induced liver injury in Latin America. An analysis of published reports. Annals of Hepatology [Internet]. 2014 mar [citado 9 feb 2022];13(2):231-9. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S1665268119308865
4. Björnsson ES. Clinical management of patients with drug-induced liver injury (dili). United European Gastroenterology Journal [Internet]. 2021 [citado 9 feb 2022];9(7):781-6. Disponible en: https://onlinelibrary.wiley.com/doi/abs/10.1002/ueg2.12113.
5. Baniasadi S, Eftekhari P, Tabarsi P, Fahimi F, Raoufy MR, Masjedi MR et al. Protective effect of N-ace-tylcysteine on antituberculosis drug-induced hepatotoxicity. European Journal of Gastroenterology & Hepatology [Internet]. 2010 oct [citado 17 dic 2021];22(10):1235-8. Disponible en: https://journals.lww.com/eurojgh/Abstract/2010/10000/Protective_effect_of_N_acetylcysteine_on.12.aspx.
6. Kumar R, Shalimar, Bhatia V, Khanal S, Sreenivas V, Gupta SD et al. Antituberculosis therapy-induced acute liver failure: magnitude, profile, prognosis, and predictors of outcome. Hepatology. 2010 may;51(5):1665-74.
7. Devarbhavi H. Antituberculous drug-induced liver injury: current perspective. Trop Gastroenterol. 2011 sep;32(3):167-74.
8. Tenório MC dos S, Graciliano NG, Moura FA, Oliveira ACM de, Goulart MOF. N-Acetylcysteine (nac): Impacts on Human Health. Antioxidants [Internet]. 2021 jun [citado 9 feb 2022 9];10(6):967. Disponible en: https://www.mdpi.com/2076-3921/10/6/967.
9. Chughlay MF, Kramer N, Werfalli M, Spearman W, Engel ME, Cohen K. N-acetylcysteine for non-paracetamol drug-induced liver injury: a systematic review protocol. Syst Rev [Internet]. 2015 dic [citado 9 feb 2022];4(1):84. Disponible en: https://systematicreviewsjournal.biomedcentral.com/articles/10.1186/s13643-015-0075-6
10. Higgins JPT, Green S, editors. Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. The Cochrane Collaboration, 2011. [Internet]. Disponible en: www.cochrane-handbook.org.
11. Page MJ, McKenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD et al. The prisma 2020 statement: an updated guideline for reporting systematic reviews. BMJ [Internet]. 2021 mar 29 [citado 13 feb 2022];372:n71. Disponible en: https://www.bmj.com/content/372/bmj.n71.
12. Gómez-Restrepo C, Okuda Benavides M. Metodología y lectura crítica de estudios Factores de confusión. Revista Colombiana de Psiquiatría. 2006;35:242-8.
13. Higgins JPT, Altman DG, G0tzsche PC, Jüni P, Moher D, Oxman AD et al. The Cochrane Collaboration's tool for assessing risk of bias in randomised trials. BMJ [Internet]. 2011 oct 18 [citado 17 feb 2022];343:d5928. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/pmc3196245/.
14. Kirkham JJ, Dwan KM, Altman DG, Gamble C, Dodd S, Smyth R et al. The impact of outcome reporting bias in randomised controlled trials on a cohort of systematic reviews. BMJ [Internet]. 2010 feb 15 [citado 17 feb 2022];340:c365. Disponible en: https://www.bmj.com/content/340/bmj.c365.
15. Singh AK, Verma S, Kumar-M P, Soni H, Sharma S, Sharma S et al. Appropriate chemopreventive strategy for anti-tubercular therapy related liver injury is unsettled: Results from a systematic review and network meta-analysis. Expert Review of Clinical Pharmacology [Internet]. 2020 nov 1 [citado 27 feb 2022];13(11):1253-62. Disponible en: https://doi.org/10.1080/17512433.2020.1835468.
16. Fox AN, Nation BE, Autry MT, Johnson PN. Possible role for acetylcysteine as a treatment for acute liver failure secondary to antitubercular medication use. American Journal of Health-System Pharmacy [Internet]. 2020 sep 15 [citado 27 feb 2022];77(18):1482-7. Disponible en: https://doi.org/10.1093/ajhp/zxaa202.
17. Hay JE. Acute liver failure. Curr Treat Options Gastro [Internet]. 2004 dic 1 [citado 6 abr 2022];7(6):459-68. Disponible en: https://doi.org/10.1007/s11938-004-0005-5.
18. Sarges P, Steinberg JM, Lewis JH. Drug-Induced Liver Injury: Highlights from a Review of the 2015 Literature. DrugSaf [Internet]. 2016 sep [citado 17 mar 2023];39(9):801-21. Disponible en: https://link.springer.com/10.1007/s40264-016-0427-8
19. Sidhu PSS. Comparison of Bovine Colostrum Versus Placebo in Treatment of Severe Alcoholic Hepatitis: A Randomized Double Blind Controlled Trial [Internet]. http://clinicaltrials.gov; 2021 dic [citado 24 feb 2022]. Report n°. nct02473341. Disponible en: https://clinicaltrials.gov/ct2/show/nct02473341
20. Cohen K. A Trial Of Intravenous N-Acetylcysteine In The Management Of Antituberculous Drug-Induced Hepatitis (nac in tb dih). Report n° nct02182167.
21. Ahmed S, Ahmed Rao N. Role of N-acetylcysteine(NAC) in preventing development of anti tuberculosis therapy(ATT) induced liver injury in pulmonary tuberculosis(PTB) patients, a simple randomized single blind clinical trial. In: Tuberculosis [Internet]. European Respiratory Society; 2020 [citado 17 mar 2023]. p. 5301. Disponible en: http://erj.ersjournals.com/lookup/doi/10.1183/13993003.congress-2020.5301
22. Sukumaran D, Usharani P, Paramjyothi GK, Subbalaxmi MVS, Sireesha K, Abid Ali M. A study to evaluate the hepatoprotective effect of N- acetylcysteine on anti tuberculosis drug induced he-patotoxicity and quality of life. Indian Journal of Tuberculosis [Internet]. 2022 jun [citado 17 mar 2023];S0019570722000804. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S0019570722000804
23. Cheng SL. Protective effect of N-acetylcysteine on antituberculosis drug-induced hepatotoxicity. European Respiratory Journal [Internet]. 2016 sep 1 [citado 6 abr 2022];48(suppl 60). Disponible en: https://erj.ersjournals.com/content/48/suppl_60/PA2716.
24. Moosa MS, Maartens G, Gunter H, Allie S, Chughlay MF, Setshedi M et al. Rechallenge after anti-tuberculosis drug-induced liver injury in a high hiv prevalence cohort. South Afr j HIV med [Internet]. 2022 jun 14 [citado17 mar 2023];23(1). Disponible en: https://sajhivmed.org.za/index.php/hivmed/article/view/1376 .
25. Luangchosiri C, Thakkinstian A, Chitphuk S, Stitchantrakul W, Petraksa S, Sobhonslidsuk A. A double-blinded randomized controlled trial of silymarin for the prevention of antituberculosis drug-induced liver injury. BMC Complement Altern Med [Internet]. 2015 dic [citado 17 mar 2023];15(1):334. Disponible en: http://bmccomplementalternmed.biomedcentral.com/articles/10.1186/s12906-015-0861-7
26. Moosa MS, Maartens G, Gunter H, Allie S, Chughlay MF, Setshedi M et al. A Randomized Controlled Trial of Intravenous N-Acetylcysteine in the Management of Anti-tuberculosis Drug-Induced Liver Injury. Clin Infect Dis. 2021 nov 2;73(9):e3377-83.
27. Zhou J, Coles LD, Kartha RV, Nash N, Mishra U, Lund TC et al. Intravenous Administration of Stable-Labeled N-Acetylcysteine Demonstrates an Indirect Mechanism for Boosting Glutathione and Improving Redox Status. J Pharm Sci. 2015 ago;104(8):2619-26.
28. Baskaran UL, Sabina EP. Clinical and experimental research in antituberculosis drug-induced hepato-toxicity: a review. Journal of Integrative Medicine [Internet]. 2017 ene 1 [citado 13 mar 2022];15(1):27-36. Disponible en: https://www.sciencedirect.com/science/article/pii/S2095496417603194.
29. Tostmann A, Boeree MJ, Aarnoutse RE, de Lange WCM, van der Ven AJAM, Dekhuijzen R. Antituberculosis drug-induced hepatotoxicity: concise up-to-date review. J Gastroenterol Hepatol. 2008 feb;23(2):192-202.
30. Shih TY, Pai CY, Yang P, Chang WL, Wang NC, Hu OYP. A novel mechanism underlies the hepatotoxi-city of pyrazinamide. Antimicrob Agents Chemother. 2013 abr;57(4):1685-90.
31. Yew WW, Chang KC, Chan DP. Oxidative Stress and First-Line Antituberculosis Drug-Induced Hepa-totoxicity. Antimicrob Agents Chemother [Internet]. 2018 jul 27 [citado 13 mar 2022];62(8):e02637-17. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/pmc6105810/.
32. Ramappa V, Aithal GP. Hepatotoxicity Related to Anti-tuberculosis Drugs: Mechanisms and Management. J Clin Exp Hepatol [Internet]. 2013 mar [citado 13 mar 2022];3(1):37-49. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/pmc3940184/.
33. Elliott TR, Symes T, Kannourakis G, Angus P. Resolution of norfloxacin-induced acute liver failure after N-acetylcysteine therapy: further support for the use of nac in drug-induced ALF? BMJ Case Rep. 2016 ene 6;2016:bcr2015213189.
34. Mumtaz K, Azam Z, Hamid S, Abid S, Memon S, Ali Shah H et al. Role of N-acetylcysteine in adults with non-acetaminophen-induced acute liver failure in a center without the facility of liver transplantation. Hepatol Int [Internet]. 2009 ago 29 [cited 2022 mar 3];3(4):563-70. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2790590/.
35. Montanini S, Sinardi D, Praticò C, Sinardi AU, Trimarchi G. Use of acetylcysteine as the life-saving antidote in Amanita phalloides (death cap) poisoning. Case report on 11 patients. Arzneimittelforschung. 1999 dic;49(12):1044-7.
36. Mudalel ML, Dave KP, Hummel JP, Solga SF. N-acetylcysteine treats intravenous amiodarone induced liver injury. World J Gastroenterol. 2015 mar 7;21(9):2816-9.
37. Alanli R, Kucukay MB, Ozdemir O. Successful treatment of amiodarone-induced hepatic injury with n-acetylcysteine: A case report. Indian J Pharmacol [Internet]. 2021 [ado 5 mar 2022];53(1):60-2. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/pmc8216127/.
38. Jaiswal P, Attar BM, Yap JE, Devani K, Jaiswal R, Wang Y et al. Acute liver failure with amiodarone infusion: A case report and systematic review. J Clin Pharm Ther. 2018 feb;43(1):129-33.
39. Farazi A, Sofian M, Jabbariasl M. Efficacy of N-Acetylcysteine on Prevention of Antituberculosis Drug-Induced Hepatotoxicity. World J Med Sci. 2015;12(4):413-8.
40. Attri S, Rana SV, Vaiphei K, Sodhi CP, Katyal R, Goel RC et al. Isoniazid- and rifampicin-induced oxi-dative hepatic injury--protection by N-acetylcysteine. Hum Exp Toxicol. 2000 sep;19(9):517-22.
41. Sahin S, Alatas O. The protective effects of n-acetylcysteine against acute hepatotoxicity. Indian J Gastroenterol. 2013 sep;32(5):311-5.