Fecha de recepción: 31 de agosto de 2022 Fecha de aceptación: 29 de mayo de 2023
CASO CLíNICO
https://dx.doi.org/10.14482/sun.40.01.787.658
Anemia hemolítica autoinmune en paciente pediátrico con infección por SARSCoV 2: reporte de un caso en Medellín, Colombia
Autoimmune hemolytic anemia in a pediatric patient with SARSCoV2 infection: a case report in Medellín, Colombia
Sara Isabel Noreña Gómez1, María Adelaida Atuesta Londoño2, Andrés Felipe Escobar González3
1 Médica general, Universidad CES. Especialista en Pediatría, Universidad CES. Médica pediatra, Clínica Las Américas AUNA, Medellín (Colombia). sarisn15@gmail.com. ORCID: https://orcid.org/0000-0002-8208-6906.
2 Médica general, Universidad CES. Especialista en Pediatría, Universidad CES. Docente Facultad de Medicina Universidad CES, Medellín (Colombia). matuestalondono@gmail.com. ORCID: https://orcid.org/0000-0002-9004-4837.
3 Médico y cirujano, Universidad Libre, Cali (Colombia). Especialista en Pediatría, Universidad de Antioquia, Medellín (Colombia). Pediatra hematólogo. Universidad Nacional Autónoma de México, México D.F. Pediatra Hematólogo, Hospital Pablo Tobón Uribe, Medellín (Colombia). pipeescobar@gmail.com. ORCID: https://orcid.org/0000-0001-9846-6615.
RESUMEN
Introducción: La enfermedad por coronavirus 2019 (Covid-19) es causada por el SARSCoV2, reportado por primera vez en noviembre de 2019 en Wuhan (China). Covid-19 tiene una presentación muy variable y se ha considerado más grave en adultos que en niños. Muchos trastornos autoinmunes se han asociado con esta enfermedad. La anemia hemolítica autoinmune (AIHA) es rara en niños, con un estimado de 0.4 por cada 100 000 años-persona.
Caso clínico: Presentamos el caso de un paciente varón hispano de 15 años con infección por SARSCoV2, con anemia hemolítica autoinmune que requirió tratamiento con corticoi-des, Rituximab, Eritropoyetina y Filgrastim por persistencia de hemólisis.
Conclusiones: La AIHA asociada al SARSCoV2 en la población pediátrica es una condición rara. Se requiere una alta sospecha clínica para iniciar un manejo rápido y evitar complicaciones mayores.
Palabras clave: Covid-19, anemia hemolítica autoinmune, Rituximab, inmunoglobulina intravenosa, respuesta autoinmune.
ABSTRACT
Introduction: The coronavirus disease 2019 (Covid-19) is caused by SARS-CoV-2, first reported in November 2019 in Wuhan, China. Covid-19 has a widely variable presentation and has been considered more severe in adults than in children. Many autoimmune disorders have been associated with this disease. Autoimmune hemolytic anemia (AIHA) is rare in children with an estimated 0.4 per in 100,000 person-years.
Clinical case: We report the case of a 15-year-old male Hispanic patient with SARSCoV2 infection, with autoimmune hemolytic anemia requiring treatment with corticosteroids, Rituximab, Erythropoietin and Filgrastim due to persistent hemolysis.
Conclusions: AIHA associated with SARS-CoV-2 in the pediatric population is a rare condition. High clinical suspicion is required to start management quickly and avoid major complications.
Keywords: Covid-19, autoimmune hemolytic anemia, Rituximab, intravenous immune globulin, autoimmune response.
INTRODUCCIóN
En diciembre de 2019, un nuevo virus fue identificado en Wuhan (China), el cual generaba un síndrome respiratorio agudo severo por coronavirus (SARS-CoV-2), un betacoronavirus transmitido principalmente por microgotas. La infección por este agente lleva al síndrome de enfermedad por coronavirus 2019 (Covid-19) (1). Rápidamente, el 30 de enero del 2020, la epidemia por Covid-19 fue declarada como emergencia de salud pública por la Organización Mundial de la Salud (OMS), y el 11 de marzo de 2020 esta misma organización declaró el origen de la pandemia, la cual se extendió por 3 años, 2 meses y 19 días, y no fue sino hasta el 5 de mayo de 2023 cuando se declaró el fin de la misma, con consecuencias devastadoras para la población mundial. Se estima que se presentaron alrededor de 7 millones de muertes, según datos registrados al 1 de junio de 2023. Según cifras del 31 de mayo de 2023, en Colombia se registró un total de 6 367 600 personas fallecidas a causa de esta infección, lo cual equivale a 2 765 95 muertes por cada millón de habitantes (2).
Múltiples manifestaciones clínicas se han registrado por esta enfermedad en la población infantil, y el sistema hematológico no fue ajeno a ello. Diversos trastornos autoinmunes en niños, incluida la enfermedad similar a Kawasaki secundaria a Covid-19, la púrpura trombocitopénica inmune (PTI) y la anemia hemolítica autoinmune (AIHA) (3). La AIHA es una forma adquirida de anemia hemolítica en la que los autoanticuerpos se dirigen a los receptores de la membrana de los glóbulos rojos (GR), lo que induce la ruptura celular (lisis) de los mismos a través del sistema mononuclear, fagocítico o del complemento. Es raro en niños, con un estimado de 0.4 por cada 100 000 años-persona (4).
Hay varios casos de AIHA reportados en adultos (5), pero pocos en la población pediátrica, por lo que el objetivo del presente trabajo es dar a conocer un caso de anemia hemolítica autoinmune desencadenada por la infección por SARSCoV2 en un adolescente sin comorbilidades.
CASO CLíNICO
Se presenta el caso de un paciente varón de 15 años sin antecedentes médicos conocidos ni antecedentes familiares de autoinmunidad. Reside en la Ciudad de Medellín, con buenas condiciones socioeconómicas y cuenta con todos los servicios públicos. Acude al servicio de urgencias con cuadro clínico de 8 días de evolución de fiebre, cefalea, artralgias, tos, rinorrea, diarrea e ictericia; al ingreso con temperatura de 38,1°C, taquicardia, con frecuencia cardíaca de 130 latidos por minuto (lpm), signos de deshidratación dados por mucosa oral seca y signo de hipoperfusión con llenado capilar prolongado.
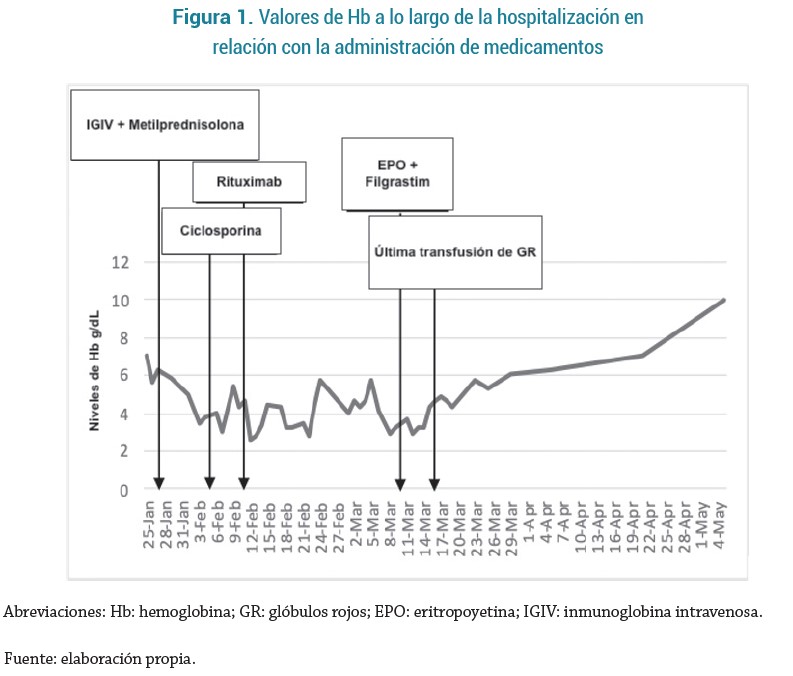
Los paraclínicos al ingreso se resumen en la tabla 1. Ante estos hallazgos, se iniciaron líquidos intravenosos, inicialmente con bolo de solución salina al 0.9 % de 20 cc/kg y posteriormente se dejó con líquidos de mantenimiento a 150 cc/h, se le transfundió 1 unidad de GR tipo O negativo por anemia sintomática y se trasladó a la unidad de cuidados intensivos pediátricos (UCIP). La reacción en cadena de la polimerasa (PCR) para SARSCoV2 fue positiva.
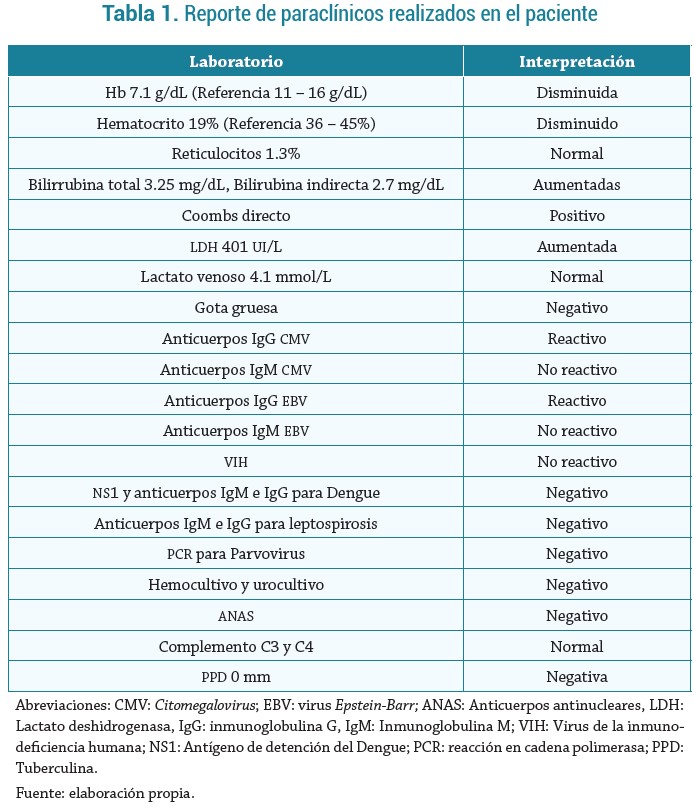
Fue tratado inicialmente con metilprednisolona 1 mg/kg por día en asociación con suplementos de ácido fólico y vitamina B12. Como se muestra en la figura 1, a pesar de recibir múltiples unidades de GR, hubo aumentos mínimos en la hemoglobina (Hb) y los valores no se mantuvieron estables; por ello, se le administró inmunoglobulina 1 gr/kg/día por 2 dosis y ciclosporina 1,3 mg/kg cada 12 horas, sin embargo, continuó con hemólisis persistente, por lo que se realizó aspirado y biopsia de médula ósea (MO). El motivo por el cual se realizó el aspirado luego del manejo con esteroides fue la presencia de insuficiencia medular, ya que en un inicio sólo se trataba de anemia hemolítica, pero posteriormente se agregó insuficiencia medular. El reporte fue negativo para malignidad y hematopoyesis normal con 30 % de celularidad de la MO, se rechazó la impresión de insuficiencia medular con aplasia roja pura y anemia arregenerativa, no hubo tampoco hemofagocitosis.
El día 18 de hospitalización se inició Rituximab 375 mg/m2 semanales en 4 dosis. En ese momento, la hemólisis cesó y las unidades de glóbulos rojos ahora se informaron compatibles, pero los niveles de Hb continuaron por debajo de 6 g/dL. Por lo tanto, se realizó un segundo aspirado de MO con una evaluación normal y un 29 % de celularidad de la médula y sin malignidad. Se inició tratamiento con eritropoyetina 4000 UI 3 veces por semana y factor estimulante de colonias de granulocitos (Filgrastim) diario con recuperación de los valores de Hb, recuento de neutrófilos y aspecto general. En total recibió 62 unidades de GR.
Un mes después del ingreso a hospitalización presentó trombosis en ambos miembros inferiores: en el lado derecho, con compromiso de la vena femoral común, la safena mayor en todo su trayecto, desde la unión con la femoral hasta el tobillo, venas poplítea, soleares, peroneas, tibiales posteriores; en el miembro inferior izquierdo, el compromiso es en las venas soleares, peroneas y tibiales posteriores, por lo que se inició manejo con enoxaparina, a dosis de anticoagulación, con posterior desmonte de forma ambulatoria y mejoría de los síntomas.
Una semana después del alta, su Hb era de 6 g/dL; los niveles han ido aumentando, y actualmente es de 13 g/dL, sin presencia de autoinmunidad.
DISCUSIóN
La capacidad de MO para generar grandes cantidades de células sanguíneas necesarias diariamente depende del proceso de proliferación y diferenciación de las células madre y progenitoras hematopoyéticas. Este proceso se puede adaptar rápidamente en condiciones de estrés (como infecciones), para satisfacer las necesidades celulares específicas de la respuesta inmunitaria y los cambios fisiológicos resultantes (6-9).
La infección por el Covid-19 no es ajena a esto. A nivel sanguíneo se ha relacionado con la presencia de linfopenia, trombocitopenia y anemia. También puede presentarse con trombocitopenia sintomática, incluida PTI, y púrpura trombocitopénica trombótica (PTT) (10). Recientemente se reportó el caso de un paciente de 9 años que presentó microangiopatía trombótica con manifestaciones dérmicas, y con compromiso hematológico, renal y neurológico secundario a infección por este virus (11).
Si bien la AIHA es un diagnóstico descrito principalmente en personas adultas, más puntualmente, en mayores de 50 años, que presentan Hb inferior a 8 g/L y síntomas que aparecen durante la primera o segunda semana de la infección por Covid-19 (10), también se han reportado casos en la población pediátrica. La mayoría de estos han sido en niños sanos (12-14); sin embargo, hay 2 casos reportados en pacientes con antecedentes patológicos, uno de ellos con PTI refractaria y otra con antecedente de beta talasemia mayor y trasplante alogénico de progenitores hemato-poyéticos (TPH); ambos mejoraron con la administración de esteroide sistémico y transfusión de GR (11, 12). En nuestro paciente se obtuvo una respuesta similar a la encontrada en pacientes previamente sanos, en los cuales en ocasiones no tienen una buena respuesta al manejo con glu-cocorticoides y requieren terapia adicional con anticuerpos monoclonales tipo Rituximab (an-ti-CD20), con el cual se han encontrado respuestas en el 80 a 90 % de los casos. La mediana del tiempo de respuesta es de 4 a 6 semanas después de la primera dosis, aunque no son infrecuentes las respuestas después de 3 a 4 meses; en nuestro paciente se encontró una respuesta a las 4 semanas, después de las 4 dosis administradas semanalmente. Los fármacos inmunosupresores convencionales (como azatioprina, ciclofosfamida, ciclosporina), aunque ampliamente utilizados en la práctica clínica, principalmente como agentes ahorradores de esteroides, están pasando a una tercera línea. Las tasas de respuesta (en su mayoría respuestas parciales) se informan en 40 a 60 %, pero se atribuyen parcialmente a la administración concomitante de esteroides. Las gam-maglobulinas intravenosas se han utilizado para AIHA secundarias a infección, con una respuesta global en el 40 % de los pacientes, mejor en un entorno pediátrico (60 %), y la EPO se ha utilizado con éxito en pacientes con AIHA multirrefractaria, y puede estar indicada particularmente en la presencia de reticulocitopenia (9).
El tiempo medio de los síntomas en los casos pediátricos reportados es de 7 días (12), mientras que Lazarian y colaboradores describen 7 casos de AIHA en relación con SARSCoV2 en pacientes adultos, en los que encontraron que el tiempo medio de los síntomas fue de 9 días (4-13 días) y el valor de Hb al momento del diagnóstico fue de 7 g/dL (3.8 - 10.8 g/dL) (16). En nuestro paciente, transcurrieron 8 días desde el inicio de los síntomas y el diagnóstico y la Hb inicial fue de 7.1 g/ dL. Similar a lo reportado en la literatura.
Múltiples infecciones se han descrito en la literatura como causantes de AIHA, tales como Parvovirus B19, virus hepatotrópico, Virus de la inmunodeficiencia humana (VIH), neumonía por Mycoplasma pneumoniae, Mycobacterium tuberculosis, brucella, sífilis (9,17). Así como también la AIHA puede ser secundaria a síndromes linfoproliferativos e inmunodeficiencia. Es por esto que las serologías para descartar dichas infecciones son recomendables dentro del enfoque del paciente. En nuestro caso, descartamos la mayoría de estos gérmenes y se realizó aspirado de MO en búsqueda de patología tumoral.
Entre las complicaciones que presentó nuestro paciente se describió la presencia de trombosis venosa profunda en ambos miembros inferiores. En la literatura está descrita la asociación entre anemia hemolítica y trombosis; su fisiopatología no está bien descrita, pero se cree que es secundaria al efecto del hem plasmático libre o Hb, depleción de óxido nítrico, anticuerpos antifosfolípidos en algunos pacientes con hemólisis autoinmune y cambios protrombóticos en la superficie de los eritrocitos, lo que provoca un estado de hipercoagulabilidad (18).
CONCLUSIóN
Se reporta el caso de un paciente adolescente con diagnóstico de anemia hemolítica autoinmune secundaria a infección por el virus SARSCoV2. Hasta el momento, la relación entre Covid-19 y la citopenia inmunomediada sigue sin estar clara. Al igual que lo encontrado en otras infecciones virales, el SARSCoV2 puede actuar como desencadenante y debe considerarse entre las causas virales de AIHA de nueva aparición. En un entorno pediátrico, el manejo clínico puede ser un desafío, particularmente en pacientes con un trastorno innato o adquirido de la regulación inmunitaria.
Aspectos éticos. Los autores declaran que para este estudio no se han realizado experimentos en humanos ni en animales, han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y han obtenido el consentimiento informado por escrito del paciente y su familia.
Conflictos de intereses: Los autores declaran no tener conflicto de intereses.
Financiamiento: Ninguno.
REFERENCIAS
1. Crawford RL, Bolin EH, Prodhan P, Renno MS, Knecht KR. Variable Presentation of COVID-19 in Pediatric Patients. Pediatr Infect Dis J. 2021 Feb;40(2):e88-90. doi: doi: 10.1097/ INF.0000000000002974.
2. Datos epidemiológicos de la crisis del Coronavirus en Colombia. Disponible en: https://datosmacro.expansion.com/otros/coronavirus/colombia. [citado 1 junio 2023].
3. Ehrenfeld M, Tincani A, Andreoli L, Cattalini M, Greenbaum A, Kanduc D et al. Covid-19 and autoimmunity. Autoimmun Rev. 2020 ago;19(8):102597.doi: 10.1016/j.autrev.2020.102597.
4. Sankaran J, Rodriguez V, Kreuter JD. Autoimmune Hemolytic Anemia in Children: Mayo Clinic Experience. J Pediatr Hematol Oncol. 2016;38(3):5. doi: 10.1097/MPH.0000000000000542.
5. Taherifard E, Taherifard E, Movahed H, Mousavi MR. Hematologic autoimmune disorders in the course of COVID-19: a systematic review of reported cases. Hematology. 2021enero;26(1):225-39. doi. 10.1080/16078454.2021.1881225.
6. Pascutti MF, Erkelens MN, Nolte MA. Impact of Viral Infections on Hematopoiesis: From Beneficial to Detrimental Effects on Bone Marrow Output. Front Immunol [Internet]. 16 de septiembre de 2016 [citado 11 agosto 2022];7. Disponible en: http://journal.frontiersin.org/Article/10.3389/fimmu.2016.00364/abstract
7. Voulgaridou A, Kalfa TA. Autoimmune Hemolytic Anemia in the Pediatric Setting. J Clin Med. de 2021 enero 9;10(2):216.
8. Angileri F, Légaré S, Marino Gammazza A, Conway de Macario E, Macario AJL, Cappello F. Is molecular mimicry the culprit in the autoimmune haemolytic anaemia affecting patients with COVID-19? Br J Haematol [Internet]. 2020 julio. doi. doi: 10.1111/bjh.16883.
9. Barcellini W, Zaninoni A, Giannotta JA, Fattizzo B. New Insights in Autoimmune Hemolytic Anemia: From Pathogenesis to Therapy. J Clin Med. 2020 nov; 9 (12):3859. doi. 10.3390/jcm9123859.
10. Ramos-Casals M, Brito-Zerón P, Mariette X. Systemic and organ-specific immune-related manifestations of COVID-19. Nat Rev Rheumatol [Internet]. 2021 abril. doi. https://doi.org/10.1038/s41584-021-00608-z
11. Domínguez-Rojas J, Campano W, Tasayco J, Siu-Lam A, Ortega-Ocas C, Atamari-Anahui N. Thrombotic thrombocytopenic purpura associated with COVID-19 in a critically ill child: a Peruvian case report. Bol Méd Hosp Infant México. de 2022 enero 31;79(2):7012.
12. Vega Hernández P, Borges Rivas Y, Ortega Sánchez E, Marqués Cabrero A, Remedios Mateo L, Silvera Roig P et al. Autoimmune Hemolytic Anemia in a Pediatric Patient With Severe Acute Respiratory Syndrome Coronavirus 2 Infection. Pediatr Infect Dis J. 2020 sep;39(9):e288-e288. doi: 10.1097/ INF.0000000000002809.
13. Rosenzweig JD, McThenia SS, Kaicker S. SARS-CoV-2 infection in two pediatric patients with immune cytopenias: A single institution experience during the pandemic. Pediatr Blood Cancer [Internet]. septiembre de 2020 [citado 10 agosto 2022];67(9). Disponible en: https://onlinelibrary.wiley.com/doi/10.1002/pbc.28503.
14. Zama D, Pancaldi L, Baccelli F, Guida F, Gottardi F, Dentale N et al. Autoimmune hemolytic anemia in children with COVID-19. Pediatr Blood Cancer [Internet]. febrero de 2022 [citado 2 junio 2023];69(2). Disponible en: https://onlinelibrary.wiley.com/doi/10.1002/pbc.29330.
15. Wahlster L, Weichert-Leahey N, Trissal M, Grace RF, Sankaran VG. COVID-19 presenting with autoimmune hemolytic anemia in the setting of underlying immune dysregulation. Pediatr Blood Cancer [Internet]. septiembre de 2020 [citado 20 junio 2022];67(9). Disponible en: https://onlinelibrary.wiley.com/doi/10.1002/pbc.28382
16. Lazarian G, Quinquenel A, Bellal M, Siavellis J, Jacquy C, Re D et al. Autoimmune haemolytic anaemia associated with COVID-19 infection. Br J Haematol. 2020 julio;190(1):29-31.
17. Phillips J, Henderson AC. Hemolytic Anemia: Evaluation and Differential Diagnosis. Am Fam Physician. 2018 sep;98(6):354-61.
18. Capecchi M, Ciavarella A, Artoni A, Abbattista M, Martinelli I. Thrombotic Complications in Patients with Immune-Mediated Hemolysis. J Clin Med. 2021 julio18;10(8):1764.